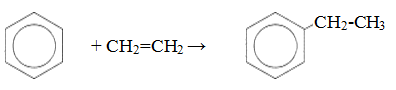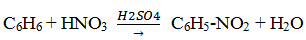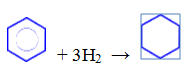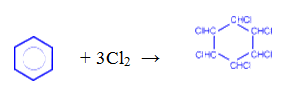- Способы получения аренов
- Получение аренов
- 1. Реакция Вюрца-Фиттига
- 2. Дегидроциклизация алканов
- 3. Дегидрирование циклоалканов
- 4. Декарбоксилирование солей бензойной кислоты
- 5. Алкилирование бензола и его гомологов
- 6. Тримеризация ацетилена
- 7. Получение стирола
- Ароматические углеводороды бензол способы получения
- Ароматические углеводороды. Бензол
- Изомерия бензолов
- Строение
- Физические свойства бензолов
- Получение
- Химические свойства бензолов
- Примеры решения задач
Способы получения аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Получение аренов
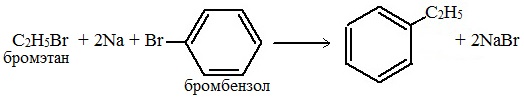
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
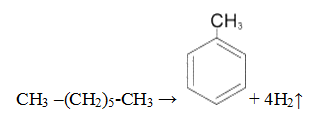
2. Дегидроциклизация алканов
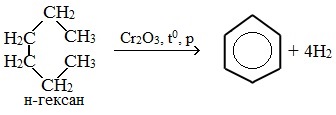
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
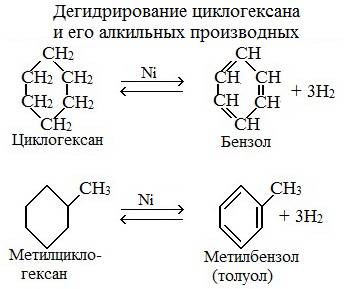
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
| Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород |
| Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород |
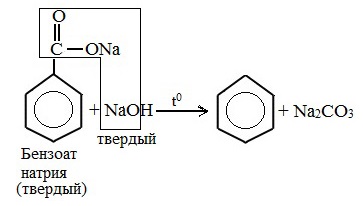
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
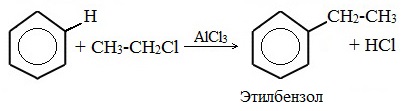
5. Алкилирование бензола и его гомологов
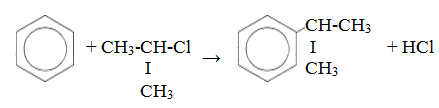
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
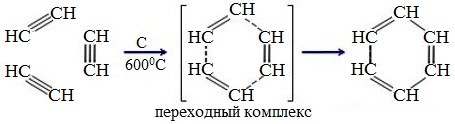
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Источник
Ароматические углеводороды бензол способы получения
Основным природным источником ароматических углеводородов является нефть и каменный уголь.
В промышленности
1.При коксовании (сухая перегонка) каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения.
2.Ароматизация нефти
а) дегидроциклизация (дегидрирование и циклизация) алканов в присутствии катализатора (с числом атомов углерода больше 6):
б) дегидрирование циклоалканов и его гомологов:
При пропускании ацетилена над активированным углем образуется бензол (реакция Зелинского):
В лаборатории
1.Декарбоксилирование солей бензойной кислоты (сплавление солей бензойной кислоты с твердой щелочью)
Соли бензойной кислоты называются бензоаты.
2.Гомологи бензола получают из галогенпроизводных (реакция Вюрца- Фиттига)
Реакции получения аренов указывают на взаимосвязь между различными группами углеводородов и на взаимное превращение их друг в друга.
3.Алкилирование бензола (получение гомологов бензола)
Гомологи бензола получают его взаимодействием с галогеналканами или алкенами в присутствии безводного хлорида алюминия (реакция Фриделя-Крафтса):
При дегидрировании этилбензола образуется производное бензола с непредельной боковой цепью – винилбензол (стирол) C6H5-CН=СН2 (исходное вещество для получения ценного полимера полистирола).
Источник
Ароматические углеводороды. Бензол
Простейшими представителями ароматических углеводородов являются бензол – C6H6 и толуол – C6H5-CH3. Углеводородные радикалы, полученные из аренов носят названия: C6H5 – — фенил (Ph-) и C6H5-CH2— — бензил.
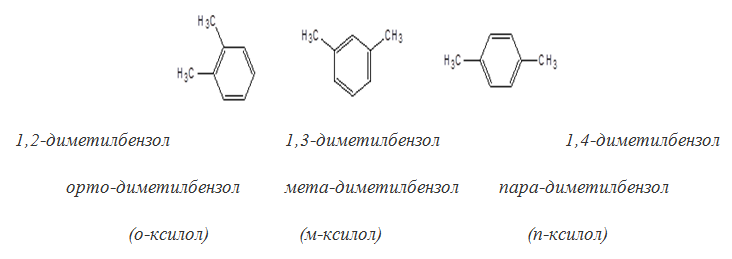
Изомерия бензолов
Изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей в ядре. Дизамещенные производные бензола существуют в виде трех изомеров, различающихся взаимным расположением заместителей. Положение заместителей указывают цифрами или приставками: орто (о-), мета (м-), пара (п-).
Строение
Все шесть атомов углерода в молекуле бензола находятся в sp 2 гибридном состоянии. Каждый атом углерода образует 3σ-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Шесть атомов углерода образуют правильный шестиугольник (σ-скелет молекулы бензола).
Каждый атом углерода имеет одну негибридизованную р-орбиталь, на которой находится один электрон. Шесть р-электронов образуют единое π-электронное облако (ароматическую систему), которое изображают кружочком внутри шестичленного цикла.
Физические свойства бензолов
Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче водды и в ней практически нерастворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями.
Получение
Основные способы получения бензола и его гомологов:
— дегидроциклизация алканов (катализаторы – Pt, Cr3O2)
— дегидрирование циклоалканов (реакция протекает при нагревании, катализатор – Pt)
— тримеризация ацетилена (реакция протекает при нагревании до 600
— алкилирование бензолов (реакция Фриделя-Крафтса) (катализатор – хлорид алюминия или ортофосфорная кислота)
Химические свойства бензолов
Для бензола и его гомологов характерны реакции замещения, протекающие по электрофильному механизму:
— галогенирование (бензол взаимодействует с хлором и бромом в присутствии катализаторов – безводных AlCl3, FeCl3, AlBr3)
— нитрование (бензол легко реагирует с нитрующей смесью – смесь концентрированных азотной и серной кислот)
— алкилирование по Фридею-Крафтсу
Реакции присоединения к бензолу приводят к разрушению ароматической системы и протекают только в жестких условиях:
— гидрирование (реакция протекает при нагревании, катализатор – Pt)
— присоединение хлора (протекает под действием УФ-излучения с образованием твердого продукта – гексахлорциклогексана (гексахлорана) – C6H6Cl6)
Примеры решения задач
| Задание | Плотность паров вещества 3,482 г/л. Его пиролиз дал 6г сажи и 5,6л водорода. Определите формулу этого вещества. |
| Решение | Найдем количество вещества сажи (углерода): |
Найдем количество вещества водорода:
Следовательно, количество вещества одного атома водорода будет равно:
v(H)=2×0,25 = 0,5 моль
Обозначим количество атомов углерода в молекуле углеводорода за х, а количество атомов водорода за у, тогда соотношение этих атомов в молекуле:
Простейшая формула углеводорода СН
Молекулярная масса углеводорода равна:
Молекулярная масса молекулы состава СН равна:
следовательно, коэффициенты х и у нужно умножить на 6, тогда искомый углеводород имеет состав C6H6 – это бензол
| Задание | Рассчитайте количество вещества ацетилена, которое понадобится для получения 400 мл бензола (плотность 0,8 г/мл). |
| Решение | Запишем уравнение реакции: |
Найдем массу бензола:
Найдем количество вещества бензола:
По уравнению реакции количество вещества ацетилена:
Источник