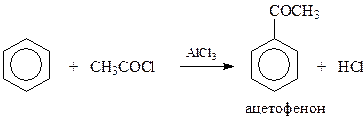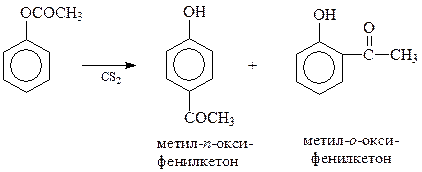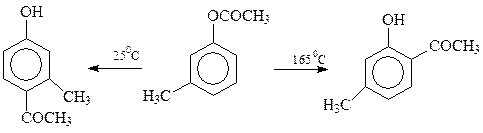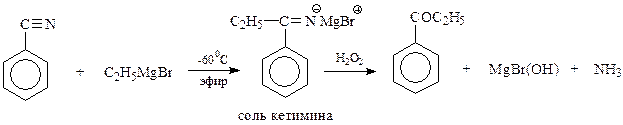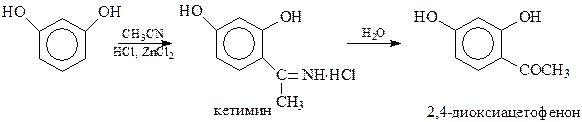Способы получения. Ароматические кетоны можно получить на основе тех же реакций, что и алифатические кетоны
Ароматические кетоны можно получить на основе тех же реакций, что и алифатические кетоны. К ним относятся реакции окисления (дегидрирования) вторичных спиртов, пиролиз кальциевых или бариевых солей карбоновых кислот, гидролиз гем-дигалогенидов и др. Дальше будут рассмотрены методы, которые не столько оригинальны, сколько часто применяются для получения кетонов определенного строения.
15.2.1.1. Ацилирование.При ацилировании ароматических соединений (реакция Фриделя-Крафтса) получаются кетоны
Эта реакция, как частный случай электрофильного замещения в ароматическом ряду, была рассмотрена раньше (смотри арены). Однако следует обратить внимание на некоторые ее особенности.
Установлено, что ацилироваться способны только ароматические соединения, несущие в кольце электронодонорные заместители. Поскольку сама ацильная группа относится к электроноакцепторным заместителям, то понятно, что две такие группы в бензольное кольцо вводить не удается.
Для ацилирования могут быть использованы карбоновые кислоты, их ангидриды и галогенангидриды. Наибольшей активностью обладают галогенацилы, наименьшей – сами кислоты.
От ацилирующего агента зависит и природа используемого катализатора. Обычно применяется хлорид алюминия, однако в случае ацилирования карбоновыми кислотами приходится использовать более сильные катализаторы – минеральные кислоты. При этом необходимо иметь в виду, что как ацилирующие агенты – ангидриды и галогенангидриды, так и образующиеся кетоны с хлоридом алюминия образуют комплексы. Поэтому катализатор приходится брать в сопоставимых с ацилирующим агентом количествах.
Перегруппировка Фриса. Для получения ароматических кетонов, содержащих в бензольном кольце гидроксильную группу, особенно подходящей является перегруппировка Фриса. Реакция заключается в перегруппировке сложных эфиров фенолов в условиях реакции Фриделя-Крафтса и обычно трактуется как ее внутримолекулярный вариант
На соотношение между образующимися о— и п-изомерами влияет природа растворителя, количество катализатора и температура реакции. Так, м-крезилацетат при 165 о С с 95%-ным выходом превращается в 4-метил-3-оксиацетофенон, а при 25 о С – в 2-метил-4-оксиацетофенон (выход 85%)
Установлено, что подобное влияние температуры – общая закономерность: при низкой температуре получаются пара-изомеры, а при более высокой температуре – орто-прозводные.
15.2.1.3. Присоединение магнийорганических соединений к нитрилам.Реактивы Гриньяра обладают способностью присоединяться по тройной связи нитрильной группы. При этом первоначально получается соль кетимина, который гидролизуется в кетон
15.2.1.4. Реакция Геша. Активированное бензольное кольцо, содержащее в виде заместителей гидроксильную группу, алкоксигруппы и др., способно конденсироваться (С-алкилирование) с нитрилами в присутствии хлористого водорода и хлористого цинка (Геш, 1915 год). Установлено, что при этом, как и в предыдущем случае, образуется кетимин, гидролизующийся в кетон
Реакцию Геша можно рассматривать и как частный случай реакции Гаттермана – конденсации фенолов и их эфиров с цианистым водородом в присутствии тех же катализаторов.
Дата добавления: 2014-12-24 ; просмотров: 2164 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Ароматические альдегиды и кетоны
1) Чисто ароматические
о-, м-, п-толуиловый альдегид


1) чисто ароматические
Способы получения
1) окисление ароматических углеводородов с боковыми цепями
V2O5 C6H5CH3 + O2  H2O + 300 0 H2O + 300 0 |  |
| толуол | бензальдегид |
2 степень окисления спирта
2) окисление спиртов
C6H5-CH2OH + O  |  | + H2O |
| бензиловый спирт | бензальдегид |
3) гидролиз дигалогенопроизводных
100 0 C C6H5-CCl2-CH3 + H2O  2 HCl + Fe 2 HCl + Fe |  |
| метилфенилдихлорметан | ацетофенол (метилфенилкетон) |
5) сухая перегонка кальциевых солей карбоновых кислот
  CaCO3 + CaCO3 + |  |
| бензоат кальция | бензофенон (дифенилкетон) |
II. Частные способы получения альдегидов и кетонов
1) Реакция Фриделя-Крафтса
 | + |  | AlCl3 безв.  -HCl -HCl | 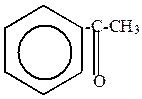 |
| хлористый ацетил (хлорангидрид уксусной кислоты) | ацетофенон |
Механизм – электрофильное замещение в ароматическом ядре.
2) Реакция Гаттермана – получение чисто ароматических альдегидов путем конденсации ароматических углеводородов с С=О.
 |  + + C=O + + C=O | +HCl  (+AlCl3) (+AlCl3) |  |
| толуол | п-толуиловый альдегид |
C=O + HCl  |  |
| хлористый формил |
Далее как в реакции Фриделя-Крафтса.
| CH3-C6H4-H + |  | AlCl3  -HCl -HCl |  |
| толуол |
3) Реакция Тимана-Реймера
Конденсация фенолов с хлороформом в присутствии щелочей
 | + |  | + 3KOH  -3 KCl -H2O -3 KCl -H2O |  | -H2O  |  |
| салициловый альдегид |
Физические свойства
Ароматические альдегиды и кетоны – маслянистые жидкости или твердые вещества желтоватого цвета с приятным запахом.
Бензальдегид – миндаль, ацетофенол – черемуха. Мало растворимы в воде.
Химические свойства
Дают многие общие реакции альдегидов и кетонов.
1. Реакции нуклеофильного присоединения и замещения.
Активность ароматических карбонильных соединений в этих реакциях ниже активности карбонильных соединений жирного ряда, особенно низкой активностью обладают чисто ароматические кетоны.
 | > |  | > |  | > | 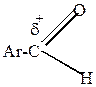 | > | 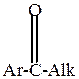 | > |
| > |  |
Объясняется это следующим. Все углеводородные радикалы обладают электронодонорными свойствами и уменьшают + 



Ароматические альдегиды не дают реакций полимеризации, чисто ароматические кетоны не присоединяют NaHSO3, не присоединяют Mg-органические соединения, не вступают в реакции конденсации друг с другом.
Ароматические альдегиды и кетоны могут присоединять HCN, образовывать оксимы, гидразоны, фенилгидразоны и т.д.
 | + HCN  |  |
| циангидрин бензальдегида | ||
 | + H2N-OH  H2O + H2O + |  |
| ацетофенон | гидроксиламин | оксим ацетофенола |
2. Перегруппировка Бекмана
Наблюдается при действии на оксимы минеральных кислот.
 | +H +  |  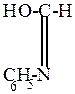 |  |  |
| синбензальдоксим | ||||
 | ||||
| N-фенилформамид |
 |  |  |  |  |
| антибензальдоксим | бензамид |
Перегруппировка Бекмана заключается в том, что к радикалу или Н, находящимся в транс-положении к группе ОН, присоединяется к азоту со стороны неподеленной пары, а ее место занимает группа ОН.
Продуктами, образующимися в результате перегруппировки Бекмана, являются замещенные амиды (син- и анти-изомеры образуют различные амиды).
II. Реакции конденсации.
Чисто ароматические не способны к реакциям альдольной конденсации между собой, но для них характерны особые виды реакций конденсации.
1) реакция Канниццаро (самоокисления-самовосстановления)
 | + |  | t + KOH  C6H5-CH2OH + конц. C6H5-CH2OH + конц. |  |
| бензальдегид | бензиловый спирт | калиевая соль бензойной кислоты | ||
 | + |  | + KOH  C6H5CH2OH + HCOOK C6H5CH2OH + HCOOK |

 | |||||
 | + OH —  |  |  |  |  OH — + OH — + |
 | KOH  омыление омыление |
2) Бензоиновая конденсация
 | + |  | (KCN)  |  |
| бензоин |
 | ||||||
 | + HCN —  |  | -H +  |  |  |  |
| протонная изомеризация | ||||||
 HCN + HCN + |  |
3) ароматические альдегиды и кетоны легко вступают в реакции конденсации с карбонилсодержащими соединениями жирного ряда, которые содержат подвижные атомы водорода в 
а) реакция Перкина – реакция с ангидридами и сложными эфирами кислот
 | + |  | (СH3COONa)  H2O + H2O + |  |  |
| бензальдегид | уксусный ангидрид | смешанный ангидрид коричной и уксусной кислоты | |||
 | + CH3COOH | ||||
| коричная кислота |
 | + |  | (Na или C2H5ONa)  H2O + H2O + |  |
| этилацетат | этиловый эфир коричной кислоты |
4) Реакция Клайзена – конденсация с альдегидами и кетонами жирного ряда
 | ||||||
 | + |  |  -H2O -H2O | 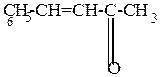 |  -H2O -H2O |  |
| бензальдегид | бензальацетон | дибензальацетон |
III. Реакции окисления и восстановления
1) Ароматические альдегиды чрезвычайно легко окисляются.
а) ароматические альдегиды окисляются кислородом воздуха – капля бензальдегида на часовом стекле через несколько минут закристаллизовывается.
 | h  + O2 + O2  |  |
Реакция идет по цепному перекисному механизму.
 | h  + O2 + O2  HOO . + свет HOO . + свет |  | ||||
 | + O2  |  | ||||
 | + |  |  |  | + |  |
| гидроперекись бензоила | ||||||
 | + |  |  |  | ||
| гидроперекись бензоила | бензойная кислота |
б) ароматические альдегиды легко окисляются слабыми окислителями, дают реакции серебряного зеркала с [Ag(NH3)4]OH
 | + 2[Ag + (NH3)2]OH —  |  | +2Ag+3NH3+H2O |
2) Ароматические кетоны окисляются труднее, например, под действием сильных окислителей, при этом группа С=О всегда остается связанной с ароматическим ядром, например,
 | +3O  (KMnO4) (KMnO4) |  | + |  |
| этилфенилкетон | бензойная кислота | уксусная кислота |
Хорошо протекает реакция окисления метилкетонов гипохлоритом.
 | + 4 NaOCl  4 NaCl + 4 NaCl + |  | + H2O + CO2 |
| ацетофенон | гипохлорит натрия | бензойная кислота |
3) Восстановление карбоннльной группы может происходить под действием различных восстановителей атомарным или молекулярным водородом.
а) восстановление молекулярным водородом до спиртов.
 | (Cu + Cr) + H2  C6H5-CH2OH C6H5-CH2OH |
| бензальдегид | бензиловый спирт |
б) восстановление атомарным водородом до пинаконов
 | + 2H  (Na в C2H5OH) (Na в C2H5OH) |  |
| ацетофенон | 2,3-дифенол-2,3-бутиндиол |
в) восстановление до углеводородов происходит под действием амальгамированного цинка и кислоты.
 | + 2 Zn(Hg) + 4 HCl  H2O + C6H5-CH2-CH3 (4H) H2O + C6H5-CH2-CH3 (4H) |
| ацетофенон | этилбензол |
IV. Реакция замещения водорода.
а) легко замещается атом водорода в 
 | + Cl2  -HCl -HCl |  |
| хлорметилфенилкетон (хлорацетофенон – ОВ со слезоточивым действием) |
б) Реакции электрофильного замещения протекают с малой скоростью в мета-положении к карбонильной группе –С-О
(группа С=О понижает электронную плотность ядра).
Источник