- Медицинские интернет-конференции
- Языки
- Апоптоз: молекулярно-клеточные механизмы развития, значение в обеспечении клеточного гомеостаза.
- Резюме
- Ключевые слова
- Статья
- Литература
- Апоптоз – программируемая клеточная смерть
- Механизм апоптоза
- Апоптоз и некроз
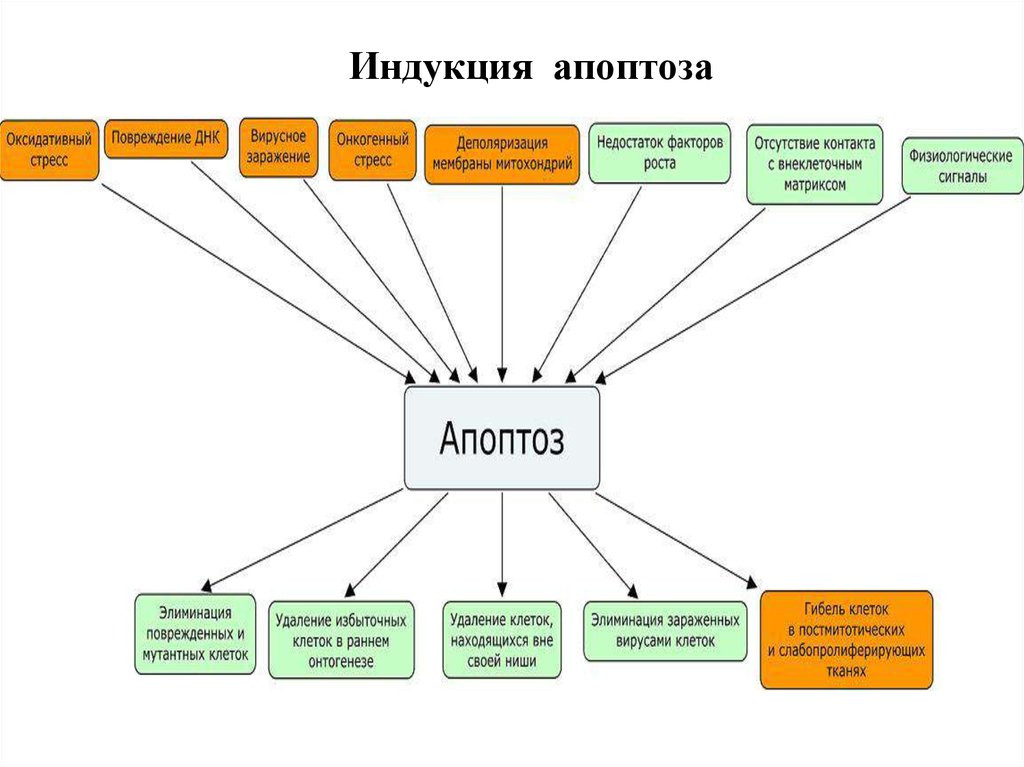
- Индукция апоптоза.
- Признаки апоптоза клетки
- Роль апоптоза в физиологических процессах организма
Медицинские интернет-конференции
Языки
Апоптоз: молекулярно-клеточные механизмы развития, значение в обеспечении клеточного гомеостаза.
Булудова М.В., Полутов В.Э.
Резюме
В работе представлены современные данные литературы, относительно механизмов развития апоптоза, его принципиальных отличий от некроза, значение в поддержании клеточного гомеостаза в лимфоидной и других пролиферирующих тканях.
Ключевые слова
Статья
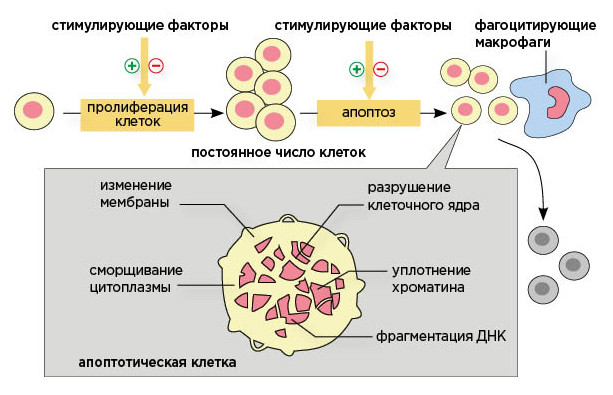
Апоптоз — форма гибели клетки, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении цитоплазматической мембраны без выхода содержимого клетки в окружающую среду. (Попков В.М., Чеснокова Н.П., Барсуков В.Ю., 2011).
Апоптоз играет жизненно важную роль в процессе эмбрионального и онтогенетического развития, имеет место при различных морфогенетических процессах, обеспечивает поддержание клеточного гомеостаза как в лимофоидной ткани, так и в других пролиферирующих тканях. Нарушение апоптоза в эмбриогенезе может приводить к внутриутробной гибели плода, врожденным уродствам или различным заболеваниям, в том числе и злокачественным новообразованиям.
Различают два типа гибели клетки: апоптоз и некроз. Принципиальные различия заключаются в следующем: некроз является результатом незапланированного события и происходит спонтанно, апоптоз формируется как четко — регулируемый, генетически-детерминируемый процесс элиминации клетки. Отличительной морфологической чертой апоптоза является коллапс ядра. Хроматин становится суперконденсированным в форме полумесяца по периферии ядра, в этот момент начинается фрагментация ДНК. Характерными признаками апоптоза, позволяющими отличить его от некроза, являются:
а) переход фосфатидилсерина из внутреннего монослоя цитоплазматической мембраны в наружный монослой; выход цитохрома С из межмембранного пространства митохондрий в цитоплазму
б) активация цистеиновых протеиназ (каспаз)
в) образование активных форм кислорода
г) сморщивание (blebbing) цитоплазматической мембраны
д) последующий распад ядра на части
е) фрагментация клеток на везикулы с внутриклеточным содержимым — апоптотические тельца
ж) апоптотические тела захватываются фагоцитирующими клетками микроокружения, как в случае некроза. При развитии апоптоза выброса клеточного содержимого не происходит, воспаление не возникает. Некроз распространяется обычно на группы клеток, в то время как апоптоз носит селективный характер в отношении отдельных клеток (Дмитриева Л.А., Максимовский Ю.М., 2009).
Стадии апоптоза
Стадия инициации. На этой стадии патогенный агент либо сам является информационным сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регуляторным структурам и молекулам. Инициирующие апоптоз стимулы могут быть трансмембранными или внутриклеточными. Трансмембранные сигналы подразделяют на отрицательные и положительные. Отрицательные сигналы обусловливают отсутствие или прекращение воздействия на клетку различных факторов роста, регулирующих деление и созревание клетки. Положительные сигналы генерируют запуск программы апоптоза. Так, связывание TNFα (FasL) с его мембранным рецептором CD95 (Fas) активирует программу смерти клетки. Среди внутриклеточных стимулов апоптоза зарегистрированы избыток Н+, свободные радикалы липидов и других веществ, повышенная температура, внутриклеточные вирусы и гормоны, реализующие свой эффект через ядерные рецепторы (например, глюкокортикоиды).
Стадия программирования. На этой стадии специализированные белки либо реализуют сигнал к апоптозу путём активации исполнительной функции, либо блокируют потенциально летальный сигнал. Выделяют два варианта реализации стадий программирования: 1) путём прямой активации эффекторных каспаз и эндонуклеаз (минуя геном клетки) и 2) опосредованной через геном передачи сигнала на эффекторные каспазы и эндонуклеазы. Прямая передача сигнала осуществляется через адапторные белки, гранзимы и цитохром С. Опосредованная передача сигнала подразумевает репрессию генов, кодирующих ингибиторы апоптоза, и активацию генов, кодирующих промоторы апоптоза.
Стадия реализации программы состоит в собственно гибели клетки, осуществляемой посредством активации протеолитического и нуклеолитического каскадов.
Непосредственными исполнителями процесса «умертвления» клетки являются Ca2+,Mg2+ -зависимые эндонуклеазы и эффекторные каспазы. В результате разрушения белков и хроматина в процессе апоптоза клетка подвергается деструкции, когда в ней формируются и отпочковываются фрагменты клетки, содержащие остатки органелл, цитоплазмы, хроматина и цитолеммы, то есть апоптозные тельца.
Стадия удаления фрагментов погибших клеток. На поверхности апоптозных телец экспрессируются лиганды, с которыми взаимодействуют рецепторы фагоцитирующих клеток. Фагоциты быстро обнаруживают, поглощают и разрушают апоптозные тельца. Благодаря этому содержимое разрушенной клетки не попадает в межклеточное пространство. (Лихтенштейн А.В., Шапот В.С., 1998).
Одно из апоптотических событий реализуется в ядре клетки и заключается в фрагментации ДНК. Деградация ДНК является терминальной фазой апоптоза, связанной с проявлением активности различных эндонуклеаз, последние обусловливают либо появление крупных фрагментов ДНК, или развитие межнуклеосомальной деградации ДНК. Считают, что этот тип деградации обеспечивается активацией Са2+, Mg2+-зависимой эндонуклеазы.
Исследования последних лет привели к формированию принципиально новых представлений о механизме гибели клеток, имеющих повреждения ДНК, как о процессе, осуществляемом в соответствии с определенной генетической программой. В индукции этой программы при наличии повреждений в ДНК клетки важная роль принадлежит белку р53. Этот белок с молекулярной массой 53 кД, локализован в ядре клетки и является одним из транскрипционных факторов. Повышенная экспрессия этого белка приводит к репрессии ряда генов, регулирующих транскрипцию и причастных к задержке клеток в фазе клеточного цикла G1. Если же активность репарационных систем недостаточна и повреждения ДНК сохраняются, то в таких клетках индуцируется программируемая клеточная гибель, или апоптоз, что приводит к защите организма от присутствия клеток с поврежденной ДНК, т.е. мутантных и способных к злокачественной трансформации.
Таким образом, при действии генотоксических агентов р53 не только увеличивает время репарации ДНК. но также защищает организм от клеток с опасными мутациями. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Механизмы индукции апоптоза
Регуляция апоптоза обеспечивается гормонами, цитокинами и в значительной мере особенностями генома. Ослабление или устранение гормональных влияний на клетки- мишени приводит, как правило, к индукции апоптоза.
Цитокины — это обширная группа белков, регулирующих пролиферацию и дифференцировку клеток при связывании со специфическими рецепторами на клетках мишенях. Цитокины подразделяются на 3 большие группы: ростовые, семейство Фактора некроза опухоли и спиральные цитокины. Эффект цитокинов на клетки неоднозначен в связи с гетерогенностью их структуры и функции: для одних клеток ряд цитокинов выступают в роли индукторов апоптоза, а для других — в роли ингибиторов апоптоза. Это зависит от типа клетки, от стадии ее дифференцировки, от функционального состояния клетки. (Goodwin P.J., Ennis M., Pritchard K.I., 2002).
Наиболее хорошо изучена последовательность событий, приводящих клетку к апоптозу в результате взаимодействия белков из семейства TNFα со специфическими рецепторами. Ярким представителем этой группы белков является система Fas/Fas-L. Следует отметить, что для этой системы не известны другие функции, кроме как индукции апоптоза клетки. Взаимодействие Fas с Fas-L (лиганд) или с моноклональными антителами приводит к апоптозу клетки. При связывании лиганда с рецептором происходит олигомеризация цитоплазматических белков: (1) DD (домен смерти), относящийся к рецептору, (2) адапторного белка — FADD (Fas-ассоциированный домен смерти), содержащий DED — эффекторный домен смерти и (3) прокаспазы-8. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Важная роль в регуляции апоптоза клеток иммунной системы принадлежит другим цитокинам -интерлейкинам, интерферонам. Было обнаружено, что интерлейкины являются индукторами апоптоза как в здоровых, так и в малигнизированных клетках и клеточных линиях. Однако не только роль индукторов апоптоза свойственна интерлейкинам, не менее выраженный эффект цитокинов наблюдается в предотвращении апоптоза. При этом один и тот же IL может быть как индуктором апоптоза, так и его ингибитором. Так, например, IL 1 является индуктором апоптоза для клеток мышиной тимомы в случаях ингибирования размножения клеток и ингибитором апоптоза для этих же клеток в случаях их интенсивного размножения. Неоднозначна и роль интерферонов по влиянию на клетки. В одних случаях IFN вызывает апоптоз (клетки костного мозга), в других — является ингибитором апоптогенного сигнала (периферические моноциты человека).
Таким образом, апоптоз является тем механизмом, который обуславливает элиминацию клеток с определенной специфичностью рецепторов. (Миронова С.П., Котельников Г.П., 2013).
В настоящее время складывается впечатление о центральной роли протеаз в запуске и развитии процесса апоптоза. Причем, по-видимому, при апоптозе, в отличие от физиологического ответа клетки, действуют свои, характерные только для апоптоза, специализированные необратимые реакции протеолиза, катализируемые специфическими протеазами, относящихся к классу цистеиновых протеаз.
Роль наследственных факторов в регуляции апоптоза
Выяснение роли белков семейства Вс1-2 занимает центральное место в изучении регуляции процесса апоптоза. К настоящему времени известно, что белки этого семейства относятся либо к индукторам апоптоза (Bad, Bax, Bcl-Xs, Bik, Bid, Bak), либо к ингибиторам (Bcl-2, Bcl-XL). Белки семейства Bcl-2 находятся в постоянном динамическом равновесии, образуя гомо- и гетеродимеры, что в конечном счете влияет на развитие апоптоза клеток. Поэтому считается, что соотношение активных форм этих белков определяют реостат жизни и смерти клетки. (Попков В.М., Чеснокова Н.П., Захарова Н.Б., 2016).
Таким образом, апоптоз является общебиологическим механизмом, ответственным за поддержание постоянства численности клеточных популяций, а также формообразование и выбраковку дефектных клеток. Нарушение регуляции апоптоза приводит к возникновению различных заболеваний, связанных с усилением или, наоборот, ингибированием апоптоза. Следовательно, изучение механизмов регуляции различных этапов данного процесса позволит определенным образом воздействовать на его отдельные этапы с целью их регуляции или коррекции. В настоящее время общепринято: если клетка погибает от апоптоза — подразумевается возможность терапевтического вмешательства, если вследствие некроза — нет. На основе знаний о программированной гибели клетки используется широкий ряд препаратов с целью регуляции этого процесса в различных типах клеток.
Многообещающими являются также подходы, связанные с регуляцией апоптоз- специфических генов и реализующиеся, в частности, в генной терапии — одной из самых перспективных областей современной медицины — при лечении заболеваний, вызванных нарушением функционирования отдельных генов. (Макаренко Н.И., Поддубная И.В., Подрегульский К.Э., 2006).
Литература
1. Дмитриева Л.А., Максимовский Ю.М. — М. : ГЭОТАР-Медиа, 2009. — 912 с. — (Серия «Национальные руководства»)
2. Кочан Е.А. Молекулярно-генетические основы канцерогенеза // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2002. — №3. — С. 32-36.
3. Лихтенштейн А.В., Шапот В.С. Опухолевый рост: ткани, клетки, молекулы // Патологическая физиология. — 1998. — №3. — С. 25-44.
4.Макаренко Н.И., Поддубная И.В., Подрегульский К.Э. Новые возможности лекарственной терапии злокачественных опухолей // — М., 2006. – С.27.
5. Миронова С.П., Котельников Г.П., / Национальное руководство / — 2-е изд., перераб. и доп. — М. : ГЭОТАР-Медиа, 2013. — 944 с.
6. Паукова В.С., Пальцева М.А., Улумбекова Э.Г. Опухолевый рост // 2-е изд., испр. и доп. — М.: ГЭОТАР-Медиа, 2015. — 2500 с.
7. Попков В.М., Чеснокова Н.П., Барсуков В.Ю., / Канцерогенез : патофизиологические и клинические аспекты/ — Саратов : Изд-во: СГМУ, 2011, 600 с.
8. Попков В.М., Чеснокова Н.П., Захарова Н.Б., под общ. ред. В.М. Попкова, Н.П. Чесноковой./ Цитокины: биологическая роль в развитии реакций адаптации и повреждения в условиях нормы и патологии различного генеза/ — Саратов: Изд-во Сарат. гос. мед. ун-та, 2016.-448 с.
Источник
Апоптоз – программируемая клеточная смерть
Природа снабдила клетки не только многочисленными механизмами защиты и репарации, но и целым набором «суицидальных» инструментов. Образно говоря, в каждой клетке есть своя собственная «гильотина».
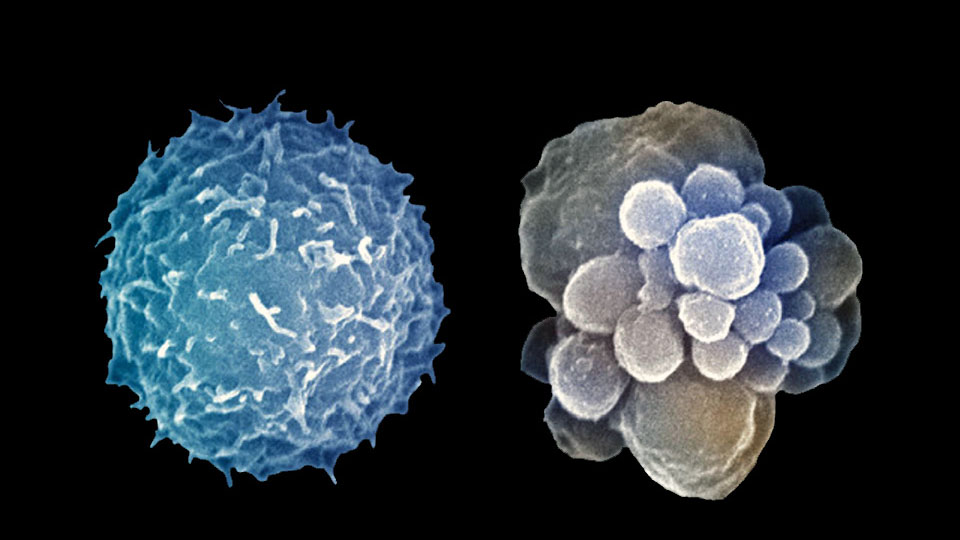
Термин «апоптоз» состоит из двух греческих слов и означает в буквальном смысле «опадание листьев». Апоптозу подвергаются клетки, закончившие цикл своего развития, – стареющие, поврежденные, мутантные, инфицированные. В многоклеточных организмах апоптоз клетки задействован в процессах дифференциации и морфогенеза, а также в поддержании клеточного гомеостаза, формировании и функционировании иммунной системы.
В настоящее время продолжаются активные исследования регуляторов и активаторов апоптоза для установления более точной картины этого процесса. Хотя механизм апоптоза клетки уже установлен.
Существует множество определений понятия «апоптоз». В некоторых источниках под ним подразумевают явление программируемой клеточной смерти, сопровождаемой набором характерных цитологических признаков (маркеров апоптоза) и молекулярных процессов, имеющих различия у одноклеточных и многоклеточных организмов (то есть изменений в строении и функционировании клетки, характерных для этого процесса). Другие источники описывают клеточный апоптоз как форму гибели клетки, проявляющуюся в уменьшении ее размера, конденсации (уплотнении) и фрагментации хроматина, уплотнении наружной и цитоплазматической мембран без выхода содержимого клетки в окружающую среду.
Механизм апоптоза
Как включается в клетке программа апоптоза? Факторы и их пусковые механизмы мы можем условно разбить на две группы:
– митохондриальный механизм;
– рецепторный механизм.
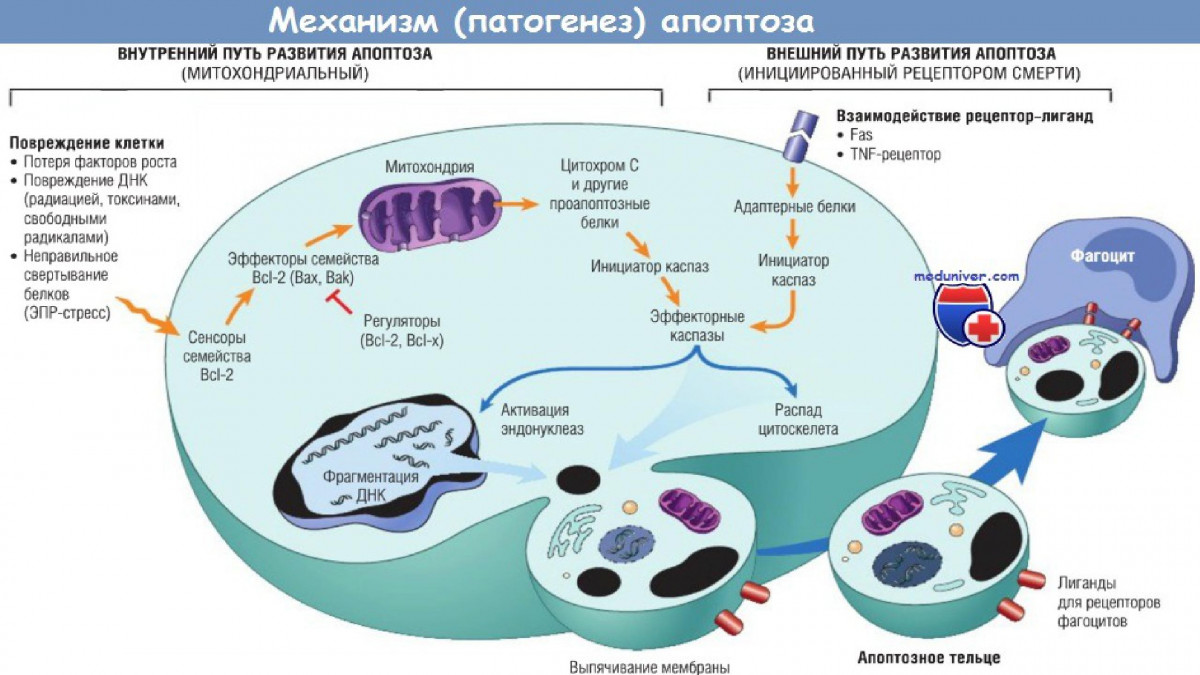
Митохондриальный механизм
Возникает при неудовлетворительном состоянии клетки, которое может быть обусловлено различными видами облучения, изменением температуры, действием химических веществ, токсинов, стрессовыми ситуациями, нарушением питания клетки и недостатком кислорода в тканях.
При всем многообразии причин запуска механизм развития апоптоза однотипен. Он связан с повреждением митохондриальной мембраны, что приводит к выходу в цитоплазму цитохромов (дыхательных ферментов, прочно связанных с мембранами митохондрий, осуществляющих в клетке перенос электронов и водорода от окисляемых органических веществ к молекулярному кислороду, при этом образуется богатое энергией соединение – АТФ). Цитохром вместе с цитоплазматическим фактором APAF-1 (Apoptose protease activation factor), неактивной каспазой и АТФ составляют апоптосомальный комплекс. Фактор APAF-1 активирует каспазы (особые протеолитические ферменты, являющиеся цистеиновыми протеазами и представленные в клетке множественными вариантами). Предполагается, что эти ферменты образуют протеолитический каскад, взаимно активируя друг друга и приводя тем самым к деградации клетки. Также в реализации этих процессов участвуют митохондриальные белки семейства Всl-2.
Рецепторный механизм
Развитие апоптоза происходит постепенно. Сигнал для начала процесса клетка получает при активации особых рецепторов, находящихся на ее поверхности. В данном случае клетка вполне жизнеспособна, но с позиций целостного организма ей посылается сигнал о «самоликвидации». Рецепторы детектируют присутствие межклеточных сигналов и в ответ на это быстро запускают внутриклеточный механизм реализации апоптоза, объединяясь в особую группу – рецепторов гибели, отличающихся от других рецепторов наличием в цитоплазматической части клетки специального «домена смерти», необходимого для включения сигнала, приводящего к апоптозу. Среди таких рецепторов наиболее известен рецептор Fas, который взаимодействуя с соответствующим лигандом (лигандом FasL), трансмембранным белком Т-киллера, активируется и запускает программу смерти клетки, инфицированной вирусом.
Пролиферация клеток и апоптоз.
Другие активаторы апоптоза
Активировать апоптоз могут также различные метаболиты и гормоны: противовоспалительные цитокины, стероидные гормоны, окись азота и свободные радикалы. Все эти факторы в свою очередь вызывают чрезмерное повреждение хромосом, многочисленные разрывы ДНК, нарушения их конформации. Пусковым моментом могут стать также повреждения внутриклеточных мембран и перекисное окисление липидов.
Для более глубокого понимания механизмов регуляции необходимо упомянуть некоторые воздействия и факторы, играющие немаловажную роль в развитии апоптоза. В 90-х годах ХХ века был открыт ряд генов, участвующих в регуляции этого процесса. Один из них кодирует белок р53, являющийся активатором апоптоза. Повышение уровня белка р53 происходит в ответ на повреждения ДНК, при этом он индуцирует процесс разными механизмами: влиянием на клеточный цикл, стимуляцией экспрессии Fas-рецептора, воздействием на соседние клетки и пр. При действии белка р53 увеличивается время репарации ДНК, что защищает организм от распространения клеток с опасными мутациями. Важно подчеркнуть, что р53-зависимый апоптоз элиминирует из организма не только поврежденные клетки, но и клетки, в которых наблюдается нерегулируемая стимуляция процессов пролиферации.
Клетка подвергается апоптозу, если в ядре происходит повреждение ДНК, которое не может быть исправлено системой репарации. За данным процессом следит белок, кодируемый геном р53.
Механизм развития апоптоза: при апоптозе происходят необратимые изменения клеточной морфологии. Клетка уменьшается и фрагментируется на апоптотические тельца, при этом клеточная мембрана остается неповрежденной. Это предотвращает вытекание токсических и иммуногенных веществ в межклеточное пространство. В случае некроза клетка распухает, мембрана разрывается и содержимое клетки выходит наружу, что приводит к воспалению.
Апоптоз и некроз
Повреждение клеточных структур, ведущее к апоптозу, не должно быть чрезмерным, иначе процесс ее гибели становится неуправляемым и представляет собой уже другую форму гибели клетки – некроз.
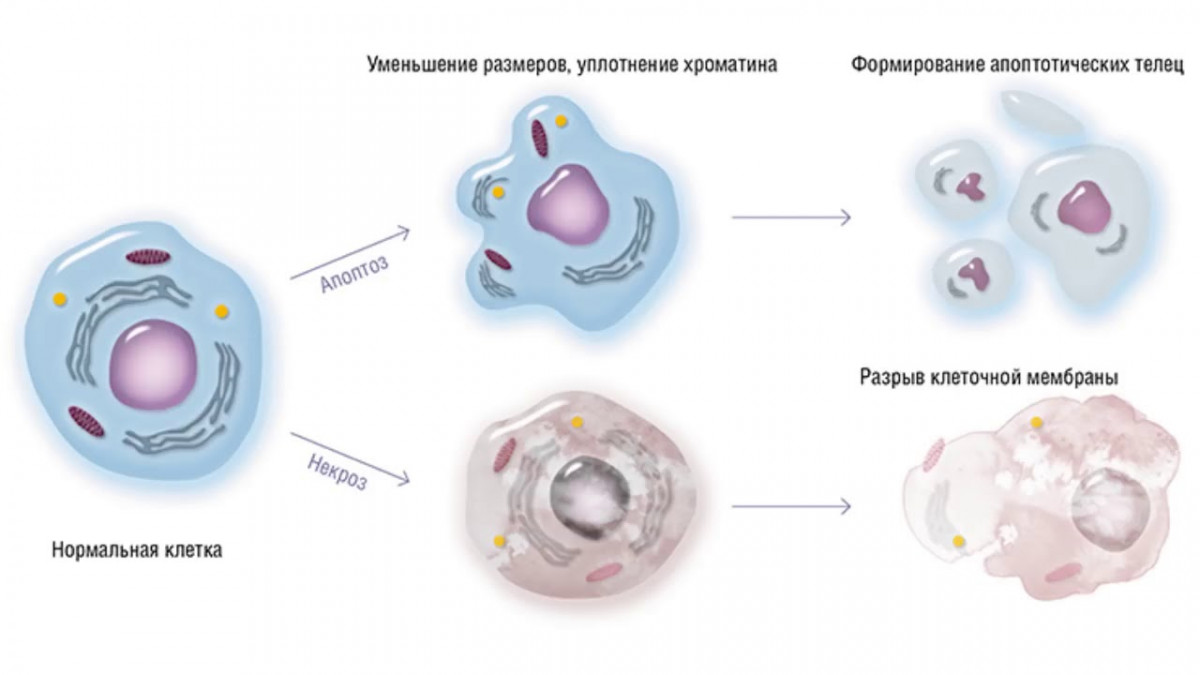
Некроз – это патологический процесс, запускающийся в ответ на какое-либо внешнее или внутренне повреждение (инфекция, химическое воздействие, облучение, недостаточное кровоснабжение и т. д.). Некроз проявляется в набухании, денатурации и коагуляции цитоплазматических белков, разрушении клеточных органелл и, наконец, всей клетки. Основу некроза составляет нарушение целостности мембраны, обеспечивающей изоляцию клетки от внешней среды. Происходит выход лизосомальных ферментов из лизосом, которые и переваривают содержимое клетки, клетка набухает, происходит разрыв мембраны с разрушением субклеточных структур вследствие осмотического шока, при этом ДНК подвергается неконтролируемой фрагментации. Содержимое клетки выбрасывается во внеклеточную среду, где поглощается фагоцитами, что приводит к развитию воспалительной реакции в окружающих тканях.
В чем отличие некроза от апоптоза? При апоптозе размер клетки, наоборот, уменьшается, мембрана уплотняется, образуются вздутия, завершающиеся формированием клеточных фрагментов, содержащие обломки ядер (апоптические тельца). Контакты с соседними клетками ослабляются, ДНК подвергается строго упорядоченной фрагментации, поскольку ее нити обрываются только между нуклеосомами (структуры, в которых упакованы ДНК). При апоптозе сохраняется целостность мембран, органеллы выглядят морфологически интактными, а продукты дробления клетки, апоптозные тельца, представляют собой отдельные фрагменты, окруженные мембраной.
Таким образом, судьба клеток, подвергшихся апоптозу и некрозу, различна. Некротическая клетка лопается, и ее содержимое оказывается в межклеточном пространстве, вызывая повреждение соседних клеток и инициируя воспаление. Апоптические же клетки сохраняют непроницаемость и очень быстро поглощаются фагоцитами. Объясняется это тем, что на поверхности клетки в процессе апоптоза появляется ряд молекул (гликопротеины, фосфатидилсерин и др.), распознаваемых фагоцитами и служащих сигналом для осуществления фагоцитоза. Основные различия между апоптозом и некрозом отражены в таблице 1.
Таблица 1. Основные различия между апоптозом и некрозом
Показатель
Апоптоз
Некроз
Пусковой фактор
Повышение проницаемости мембран митохондрий или сигнал, воспринимаемый мембранными рецепторами
Неадекватные условия среды, токсические агенты
Скорость развития
1–4 ч
Менее часа
Причины гибели клетки
Нарушение энергетики клетки, деградация ДНК
Нарушение целостности мембраны, осмотические процессы
Изменение размера клетки
Уменьшение (сморщивание)
Увеличение (набухание)
Изменение ядра
Конденсация хроматина, фрагментация
Набухание
Изменение в цитоплазме
Конденсация цитоплазмы, уплотнение гранул
Лизис гранул
Изменение клеточной мембраны
Потеря микроворсинок, образование вздутий, уплотнений
Нарушение целостности
Состояние ДНК
Упорядоченная (межнуклеосомная) деградация
Неупорядоченная деградация
Энергозависимость
Зависит
Не зависит
Стадии апоптоза
Механизмы апоптоза сложны и многообразны. Они представляют собой сложнейший молекулярный каскад, изучением которого занимаются многие лаборатории по всему миру. Несомненная важность этих исследований в аспекте онкологии и геронтологии доказана успехами терапии онкологических заболеваний индукторами апоптоза раковых клеток.
В развитии апоптоза выделяют три стадии:
- сигнальную (индукторную);
- эффекторную;
- деградации (деструкции).

Индукция апоптоза.
Итак, апоптоз: активация процесса начинается с получения клеткой сигнала о том, что ее гибель необходима для дальнейшей жизнедеятельности организма. Индукторами апоптоза могут быть как внешние (внеклеточные) факторы, так и внутриклеточные сигналы. Сигнал воспринимается рецептором и далее последовательно передается молекулам-посредникам (мессенджерам) различного порядка и достигает ядра, где происходит включение программы клеточного «самоубийства». В ядре регистрируются первые морфологические признаки апоптоза – конденсация хроматина с формированием его осмиофильных скоплений, прилежащих к ядерной мембране. Позже появляются инвагинации (вдавления) ядерной мембраны, и происходит фрагментация ядра. В основе деградации хроматина лежит ферментативное расщепление ДНК. Сначала образуются фрагменты, включающие 700, 250, 70 тысяч пар оснований, затем – фрагменты, содержащие 30–50 тысяч пар оснований. После реализации этого этапа процесс становится необратимым.
Затем наступает межнуклеосомная дезинтеграция ДНК, то есть разрывы нитей ДНК, находящихся между нуклеосомами. Отделившиеся фрагменты ядра, ограниченные мембраной, называют апоптотическими тельцами. В цитоплазме происходит расширение эндоплазматического ретикулума, конденсация и сморщивание гранул.
Признаки апоптоза клетки
Важнейшим признаком апоптоза является снижение трансмембранного потенциала митохондрий и выход в цитоплазму различных апоптогенных факторов (цитохрома, прокаспаз, апоптоз-индуцирующего фактора). Именно нарушению барьерной функции митохондриальных мембран отводят ключевую роль в развитии многих типов апоптоза. Клеточная мембрана утрачивает ворсинчатость и образует пузыревидные вздутия. Клетки округляются и отделяются от субстрата. На поверхности клетки экспрессируются различные молекулы, распознаваемые фагоцитами, в результате чего происходит поглощение тела клетки другими клетками и его деградация в окружении лизосом фагоцитарных клеток.
Роль апоптоза в физиологических процессах организма
- Удаление генетически дефектных, предопухолевых клеток.
- Роль в эмбриогенезе (разрушение различных тканевых зачатков и формировании органов).
- Участие в иммунной системе (уничтожение аутореактивных клонов Т-лимфоцитов и др.).
- Участие в женской репродуктивной системе (гибель фолликулярных клеток и др.).
- Устранение поврежденных и стареющих клеток – фибробластов, гепатоцитов.
- Элиминация постмитотических клеток – нейронов, кардиомиоцитов.
- Сохранение тканевого гомеостаза – поддержание постоянного числа клеток.
- Влияние на развитие дегенеративных или неопластических возрастных изменений.
- Реализация некоторых эффекторных функций иммунитета
- Влияние апоптоза на процессы старения
Современные сведения показывают, что имеется взаимосвязь между нарушениями регуляции апоптоза и целым рядом возрастных патологий и фенотипов старения. Одна из гипотез объяснения молекулярно-генетических механизмов старения организма постулирует: старение организма – это, по сути, апоптоз, старение ключевых клеток, гибель которых способна повлиять на физиологию всего организма. До сих пор идут дискуссии о роли апоптоза в процессе старения, при этом часть исследователей являются сторонниками теории клеточного апоптоза, придерживаясь мнения, что старение происходит в результате того, что в организме гибнет больше клеток, чем рождается, а отмирающие функциональные клетки заменяются соединительной тканью. Исходя из этой теории, старость – это болезнь, которую можно и нужно лечить, а программу старения организма возможно вывести из строя и тем самым выключить механизм, сокращающий нашу жизнь.
Людмила Бравинская, косметолог-методист, Одесский медицинский университет, Одесса
Источник