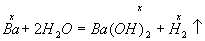Растворы. Способы выражения концентрации растворов
Материалы портала onx.distant.ru
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0%
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
Мольный процент представляет мольную долю, умноженную на 100:
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0
Объёмный процент представляет собой объёмную долю, умноженную на 100.
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см 3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4 в кислой среде | ? | 0,03 М KMnO4 в нейтральной среде | ? |
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4 в нейтральной среде | 0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см 3 .
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см 3 .
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см 3 ), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см 3 .
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см 3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
Источник
Аналитические способы выражения концентрации растворов.
Моляльная концентрация (моляльность) – величина, показывающая, сколько молей растворенного вещества в растворе приходится на 1 кг растворителя:
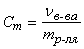
где Vв-ва – количество растворенного вещества в растворе, моль; mр-ля – масса растворителя в растворе, кг.
Титр – величина, показывающая, какая масса растворенного вещества содержится в 1 мл раствора:
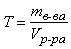
где mв-ва – масса растворенного вещества в растворе, г; Vр-ра – объем раствора, мл.
Мольная доля вещества в растворе представляет собой отношение числа молей этого вещества к суммарному количеству молей всех компонентов раствора:

где Vв-ва – число молей компонента, для которого определяется мольная доля; n – количество компонентов раствора.
Количественный состав раствора чаще всего выражается с помощью понятия «концентрации», под которым понимается содержание растворенного вещества (в определенных единицах) в единице массы или объема.
Договорились растворенное вещество обозначать через X, а растворитель — через S.
Чаще всего для выражения состава раствора используют массовую долю, молярную концентрацию (молярность) и мольную долю.
Массовая доля — это отношение массы растворенного вещества к общей массе раствора. Для бинарного раствора:
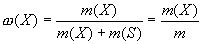
где ω(Х) — массовая доля растворенного вещества X; m(Х) масса растворенного вещества X, г; m(S) — масса растворителя S, г; m= [m(Х) + m(S)] — масса раствора, г.
Массовую долю выражают в долях единицы или в процентах (например: ω = 0,01 или ω = 1%).
Молярная концентрация (молярность) показывает число молей растворенного вещества, содержащегося в 1 литре раствора:
где С(Х) — молярная концентрация растворенного вещества X, моль/л; v(Х) — количество растворенного вещества X, моль; V — объем раствора, л.
Как следует из (2), молярная концентрация выражается в моль/л. Эта размерность иногда обозначается М, например: 2МNаОН.
Мольная доля растворенного вещества — безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
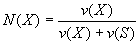
где N(Х) — мольная доля растворенного вещества X; v(Х) — количество растворенного вещества X, моль; v(S) — количество вещества растворителя S, моль.
Нетрудно представить, что сумма мольных долей растворенного вещества и растворителя равна 1:
При решении многих задач полезно переходить от молярной концентрации к массовой доле, мольной доле и т.д. Например, молярная и процентная концентрации взаимосвязаны так:
C(X) = 10 ∙ ω(X) ∙ ρ / M(X), (5)
ω(X) = C(X) ∙ M(X) / (10 ∙ ρ) (6)
где ω(Х) — массовая доля растворенного вещества, выраженная в %; М(Х) — молярная масса растворенного вещества, г/моль; р = m/(1000 V) — плотность раствора, г/мл.
Очень часто концентрацию насыщенного раствора, наряду с вышеперечисленными характеристиками, выражают через так называемый коэффициент растворимости или просто растворимость вещества.
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют коэффициентом растворимости:
Растворимость вещества s показывает максимальную массу вещества, которая может раствориться в 100 г растворителя:
5. Расчётные формулы и техника приготовления растворов кислот, солей и щелочей технических и аналитических концентраций.
Задача 1. В лаборатории имеется раствор с массовой долей гидроксида натрия 25%, плотность которого равна 1,27 г/мл. Рассчитайте его объём, который надо смешать с водой, чтобы получить 500 мл раствора с массовой долей NаОН 8% (плотность 1,09 г/мл).
Решение. Будем обозначать величины, относящиеся к исходному раствору, индексом “1” (например, m1 – масса исходного раствора); величины, относящиеся к раствору, который надо приготовить, — индексом “2” (m2 – масса раствора, который надо приготовить); величины, одинаковые для обоих растворов, индекса иметь не будут.
1. Рассчитываем массу раствора NaOH, который требуется приготовить:
2. Определяем массу NaOH, которая будет содержаться в растворе (такая же масса гидроксида натрия должна содержаться и в исходном растворе, которая будет разбавлена водой):
Вычисляем массу раствора с ω1(NaOH) = 25%, в котором содержится гидроксид натрия массой 43,6 г:
3. Рассчитываем объём исходного раствора NaOH, который надо разбавить водой:
V1 = 
Ответ: объём гидроксида натрия 137,3 мл.
Задача 2. Реакция протекает по уравнению ЗВа 2 + + 2РО4 3- = Ва3(РO4)2↓
Напишите два разных уравнения в молекулярной форме, соответствующих этой реакции.
Решение. К ионам в левой части исходного уравнения допишем ионы с противоположным значением заряда с таким коэффициентом, чтобы можно было составить формулы веществ. При этом учитываем,что исходные вещества должны быть достаточно хорошо растворимы в воде. Затем те же ионы с теми же коэффициентами пишем в правой части уравнения:
6Cl — + 6Н + = 6Сl — + 6Н +
Объединяя ионы обоих равенств в молекулы, получим уравнение реакции в молекулярной форме:
Аналогично подбираем и другие подходящие ионы:
Получаем второе уравнение в молекулярной форме:
Задача 3. Принимая, что серная кислота диссоциирует полностью, определите рН её 0,012 М раствора.
Решение. Запишем уравнение полной диссоциации серной кислоты на ионы:
H2SO4 
Как видим, из 1 моль кислоты образуется 2 моль Н + . Соответственно из 0,012 моль кислоты образуется 0,024 моль Н + . Концентрация ионов водорода в растворе будет равна 0,024 моль/л.
Отсюда рН = -lg[Н + ]; рН = -lg 0,024 = 1,62.
Задача 4. Какое количество бария нужно взять, чтобы при его взаимодействии с 1л воды образовался 2%-ный раствор гидроксида бария?
Решение. Барий растворяется в воде по уравнению
Пусть в реакцию вступило х моль Ва, тогда образовалось по x моль Ва(ОН)2 (М=171) и Н2. Масса вещества Ва(ОН)2 в растворе составляет 171x, а масса раствора равна:
m(р-ра) = 1000 + m(Ba) — m(Н2) = 1000 +137x – 2x = 1000+135x.
Массовая доля гидроксида бария равна:
ω(Ва(ОН)2) =171x / (1000 +135x) = 0,02.
Ответ. 0,119 моль Ва.
Задача 5. Рассчитайте массовые доли веществ в растворе, образовавшемся при действии 25 мл 20%-ной соляной (плотность 1,1 г/мл) на 4,0 г сульфида железа (II).
Решение. Сульфид железа (II) растворяется в соляной кислоте по уравнению
| 0,0455 | 0,091 | 0,0455 | 0,0455 | |||
| FeS | + | 2HCl | = | FeCl2 | + | H2S↑ |
m(р-ра НСl) = 25∙1,1 = 27,5 г. m(НСl) = 27,5∙0,2 = 5,5 г. v(НСl) = 5,5 / 36,5 = 0,151. v(FеS) = 4,0 / 88 = 0,0455. FeS находится в недостатке, и расчет по уравнению реакции надо вести по FеS.
В результате реакции образуется по 0,0455 моль FeСl2 (массой 0,0455∙127 = 5,78 г) и Н2S (массой 0,0455∙34=1,55 г), и расходуется 0,091 моль НСl. В растворе останется 0,151-0,091 = 0,06 моль НСl массой 0,06∙36,5 = 2,19 г.
Масса образовавшегося раствора равна:
m(р-ра) = 27,5 + m(FеS) — m(Н2S) = 27,5 + 4,0 — 1,55 = 30,0 г.
Массовые доли веществ в растворе:
ω(FеСl2) = 5,78 / 30,0 = 0,193, или 19,3%,
Источник