Аммиак собирают способом вытеснения воздуха
Из курса химии Вам известно, что при получении газообразных веществ в лаборатории собирать получаемый газ можно двумя способами: вытеснением воды и вытеснением воздуха. На рис. 1–3 изображены приборы для получения и собирания различных газов.
Известно, что хлороводород — газ, без цвета, тяжелее воздуха и хорошо растворимый в воде. Какие способы из тех, которые приведены на рисунках, нельзя использовать для собирания хлороводорода? Укажите, какое свойство хлороводорода надо учитывать, отвергая этот способ.
Запишите в таблицу номер соответствующего рисунка и свойство газа.
| Метод собирания газа | Номер рисунка | Свойство газа |
| Метод вытеснения воздуха | ||
| Метод вытеснения воды |
1. Газ тяжелее воздуха, поэтому его нельзя собрать так, как это показано на рисунке № 2.
2. Газ растворим в воде, поэтому его нельзя собрать методом вытеснения воды как на рисунке № 3.
Ответ: Метод вытеснения воздуха — 2 — газ тяжелее воздуха; метод вытеснения воды — 3 — газ растворим в воде.
Источник
§ 23. Аммиак

Какую степень окисления имеет атом азота в аммиаке и почему?
Какая связь называется водородной? Покажите на примере молекулы воды, изучив схему ее образования (см. учебник химии для 8 класса).
Аммиак — одно из важнейших водородных соединений азота (их у него несколько). Он имеет огромное практическое значение. Жизнь на Земле обязана своим существованием способности некоторых бактерий превращать азот воздуха в аммиак.
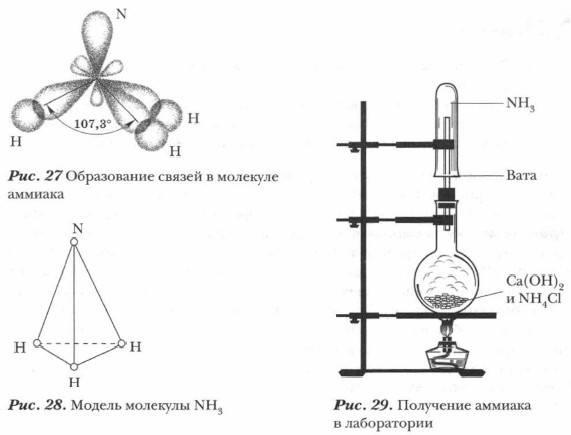
Строение молекулы аммиака. Молекула аммиака образуется за счет ковалентных связей трех p-электронов атома азота с тремя s-электронами атомов водорода (см. рис. 27). Вследствие разницы значений ОЭО атомов азота и водорода связи N—Н полярны. Общие электронные пары смещены к атому азота как к более электроотрицательному. Три атома водорода присоединяются к атому азота так, что их связи образуют углы около 100°, т. е. молекула аммиака имеет пирамидальную форму. Одна из вершин молекулы аммиака занята неподеленной электронной парой атома азота (см. рис. 28). Молекула аммиака сильно полярна.
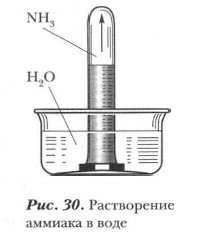
Получение аммиака. Аммиак может быть получен несколькими способами. В лаборатории аммиак получают действием щелочей на соли аммония при нагревании (см. рис. 29).

Концентрированный раствор аммиака, поступающий в лаборатории, содержит 25% аммиака. В домашнем обиходе используется аптечный раствор «нашатырный спирт», содержащий 10% аммиака.
Физические свойства аммиака. Аммиак — бесцветный газ с резким запахом, почти в два раза легче воздуха. Его относительная плотность по воздуху dв равна 0,48. При охлаждении аммиака до -33 °С он сжижается.
Аммиак прекрасно растворяется в воде вследствие своей полярности (в 1 объеме воды растворяется 700 объемов аммиака), а также благодаря образованию водородных связей между молекулами аммиака и воды.

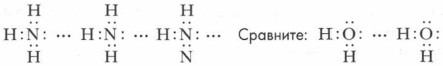
Водородная связь возникает между атомом водорода одной молекулы аммиака, несущим частичный положительный заряд, и электроотрицательным атомом азота другой молекулы аммиака.

Для демонстрации хорошей растворимости аммиака в воде можно провести опыт «Фонтан», который описан при изучении растворимости хлороводо- рода в 8 классе.
Растворимость аммиака еще больше, чем у НСl: в колбе создается вакуум, и немедленно начинает бить фонтан. Если добавить в раствор аммиака лакмус или фенолфталеин, они покажут не кислотный, а щелочной характер раствора, что указывает на наличие в нем гидроксид-иона.

Откуда они взялись в растворе? По всей вероятности, вследствие отнятия от молекул воды ионов водорода Н + молекулами аммиака.
Проблема. Откуда и как в данном растворе появились гидроксид-ионы?
Обратимся вновь к анализу происходящего и с помощью ионных уравнений рассмотрим механизм процесса:
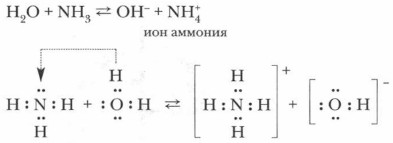
Задание. Попробуйте самостоятельно объяснить этот процесс.

При работе с аммиаком надо помнить, что даже незначительное содержание его приводит к раздражению слизистой оболочки носа, горла и т. д. Повышенное содержание аммиака в воздухе приводит к поражению глаз, воспалению легких.
Средства первой помощи при отравлении аммиаком: свежий воздух, обильное промывание глаз водой, вдыхание водяного пара.
Химические свойства аммиака. Аммиак — химически активное соединение. Он вступает в реакции со многими веществами. Наиболее характерны для него реакции окисления и присоединения, что связано со степенью окисления азота (-3) в молекуле аммиака и с особенностями ее строения.
1. Реакции окисления. В окислительно-восстановительных реакциях аммиак может выступать только в качестве восстановителя.
Он вступает в окислительно-восстановительную реакцию с кислородом — горит в кислороде:
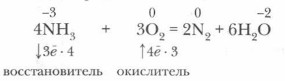

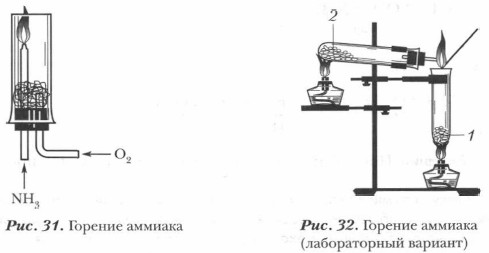


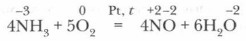
Эта реакция имеет большое значение, так как лежит в основе промышленного получения азотной кислоты из аммиака.
Источник
Урок по химии на тему «Практическая работа №3 Получение аммиака и изучение его свойств. «
Химия 9 класс Учитель Федорова О.В.
Тема урока: Практическая работа №3 Получение аммиака и изучение его свойств.
Цель урока: познакомить обучающихся с лабораторным способом получения аммиака, совершенствовать умения собирать газ методом вытеснения воздуха, провести опыты, характеризующие химические свойства аммиака, совершенствовать умения составлять уравнения химических реакций в молекулярном и ионном виде.
— уметь собирать простейший прибор для получения аммиака;
— уметь собирать аммиак методом вытеснения воздуха;
— уметь составлять уравнения химических реакций в молекулярном и ионном виде;
— соблюдать правила техники безопасности при выполнении практической работы.
— формировать умения самостоятельно планировать пути достижения целей;
— определять способы действий в рамках предложенных условий, строить умозаключения и делать выводы.
—формировать ответственное отношение к учению, коммуникативную компетентность в общении со сверстниками.
Тип урока: практическая работа
Оборудование: лабораторные штативы, пробирки, лапки, пробка с газоотводной трубкой, спиртовка, фарфоровая ступка, пестик, пробка, кристаллизатор с водой, вата, цилиндр с кислородом, лучина.
Реактивы: кристаллический NH 4 Cl , Ca ( OH )2, растворы соляной, серной кислот, лакмусовая бумага, фенолфталеин.
I Организационный момент
II Актуализация опорных знаний обучающихся
1. По какому механизму образуется ион аммония?
2. Какие свойства, кислотные или основные, проявляет гидроксид аммония?
3. Как меняют цвет индикаторы в щелочной среде?
4. Как в лабораторных условиях получить аммиак?
5. Как должна быть расположена в штативе пробирка для собирания аммиака? Почему?
6. Иногда пробирка для получения аммиака при нагревании лопается. Почему? Каким образом нужно нагревать?
7. Как определить выделение аммиака?
8. Что будем наблюдать при опускании пробирки с аммиаком в воду?
Ответы на вопросы:
1. По донорно – акцепторному механизму образуется ион аммония?
2. Гидроксид аммония в водном растворе проявляет основные свойства.
3. Лакмус в щелочной среде становится, синим, фенолфталеин – малиновым.
4. В лабораторных условиях получить аммиак можно при взаимодействии хлорида аммония с гидроксидом кальция?
5. Пробирка для собирания аммиака должна быть расположена вверх дном, т.к. аммиак легче воздуха.
6. Пробирку для получения аммиака сначала нужно прогреть по всей длине, т.к. при не правильном нагревании пробирка может лопнуть из – за разницы температур.
7. Выделение аммиака можно определить по появлению резкого характерного запаха.
8. При опускании пробирки с аммиаком в воду будем наблюдать быстрое заполнение пробирки водой, т.к. аммиак очень хорошо растворим в воде.
III Мотивация учебной деятельности
Эта история произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля. Как вы думаете, какое это вещество? Почему были от его воздействия такие последствия?
IV Текущий инструктаж
Осторожно обращайтесь с химическим оборудованием!
А) При работе со стеклом (пробирки, колбы, стаканы, трубки) всегда помните, что стекло — очень хрупкий материал и что его легко разбить. Поэтому избегайте чрезмерных усилий, когда закрепляете посуду в штативе, когда вставляете пробку в пробирку или колбу; держите их у ранта (у горлышка).
Б) При работе с растворами кислот или щелочей проявите осторожность. Если кислота или щелочь попала на кожу – не паникуйте, а сообщите об этом учителю, и немедленно промойте большим количеством проточной воды.
В) При выяснении запаха веществ не подносите сосуд близко к лицу, иначе вдыхание паров и газов может вызвать раздражение дыхательных путей.
Следует обратить внимание учащихся на то, что запах аммиака очень резок. Настолько, что может привести в чувство человека, потерявшего сознание, когда к его носу подносят ватку, смоченную нашатырным спиртом(10%-ным водным раствором аммиака). Вдыхание больших количеств аммиака сопровождается удушьем, слезотечением, головокружением и болями в желудке. Поэтому желательно провести все опыты быстро, перенести прибор под тягу и не вдыхать аммиак.
Г) Тушите спиртовку только колпачком (а).
Запрещается зажигать одну спиртовку с помощью другой (б).
Запрещается передавать спиртовку в зажженном виде (в).
Д) Запрещается пробовать вещество на вкус (г).
Е) Работу проводить только над столом (д).
V Выполнение практической работы (инструктивная карта по проведению практической работы распечатана и раздается на каждую парту)
VI Оформление отчета о практической работе в тетрадях (отчет должен содержать: названия опытов, уравнения реакций, наблюдения и вывод)
VII Домашнее задание
Повторить §23 – 25
Что нового вы узнали?
Какие цели были вами достигнуты в результате выполнения практической работы?
Какое практическое применение для вас имеют полученные знания?
Источник