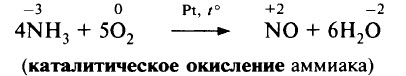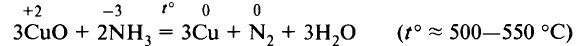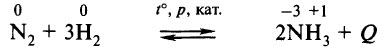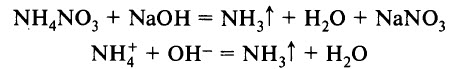Урок №30. Аммиак. Физические и химические свойства. Получение и применение
Аммиак – NH 3
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH 2 ) 2 CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан . Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
Строение молекулы
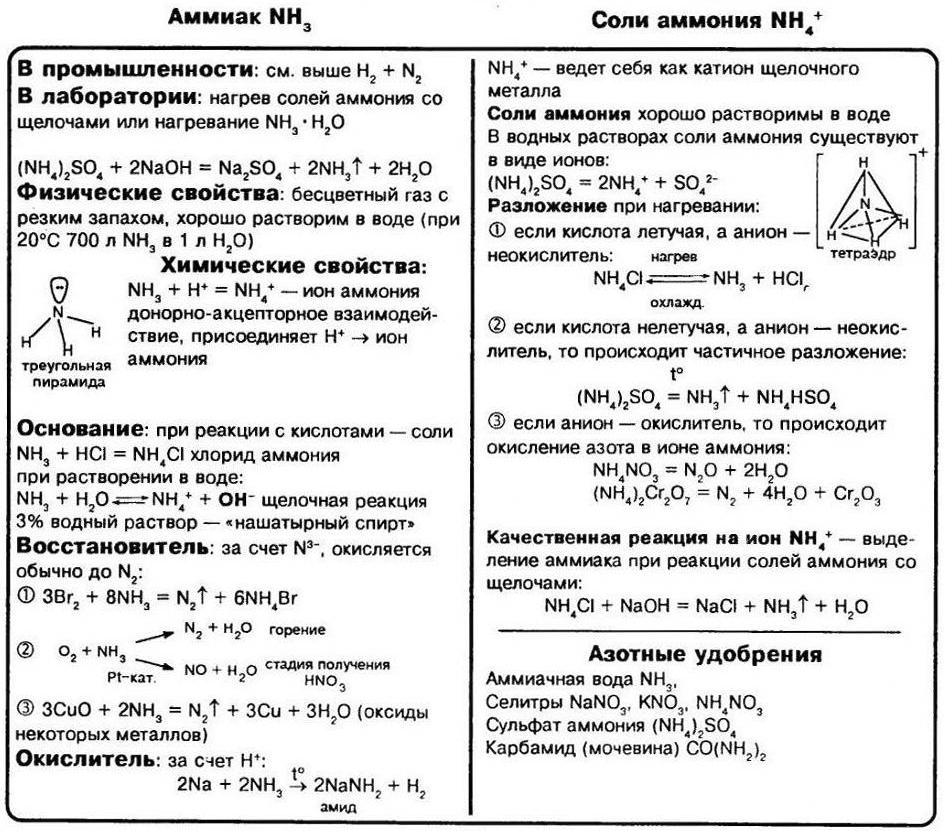
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH 4 + .
Вид химической связи: ковалентная полярная, три одинарные σ — сигма связи N δ- ← H δ+
Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH 3 в воде чрезвычайно велика — около 1200 объёмов (при 0°C) или 700 объёмов (при 20°C) в объёме воды.
Получение аммиака
В лаборатории
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH 4 Cl + NaOH = NH 3 ↑ + NaCl + H 2 O
(NH 4 ) 2 SO 4 + Ca(OH) 2 = 2NH 3 ↑ + CaSO 4 + 2H 2 O
Внимание! Гидроксид аммония неустойчивое основание, разлагается:
NH 4 OH ↔ NH 3 ↑ + H 2 O
При получении аммиака держите пробирку — приёмник дном кверху, так как аммиак легче воздуха.
В промышленности
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N 2(г) + 3H 2(г) ↔ 2NH 3(г) + 45,9 кДж
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Химические свойства аммиака
Реакции с изменением степени окисления атома азота (реакции окисления)
N -3 → N 0 → N +2
NH 3 – сильный восстановитель
1. Горение аммиака
4NH 3 + 3O 2 = t = 2N 2 + 6H 2 О
2. Каталитическое окисление аммиака
4NH 3 + 5O 2 = t, кат. Pt – Rh = 4NO + 6H 2 O
3. С оксидами металлов
2NH 3 + 3CuO = 3Cu + N 2 + 3H 2 O
4. С сильными окислителями
2NH 3 + 3Cl 2 = t = N 2 + 6HCl
5. Аммиак – непрочное соединение, при нагревании разлагается
2NH 3 = t = N 2 + 3H 2
Реакции без изменения степени окисления атома азота
Присоединение происходит по донорно-акцепторному механизму с образованием иона аммония NH 4 + , входящего в состав соединений аммония:
(NH 4 ) n А – соли аммония
NH 4 ОН – гидроксид аммония (правильная запись NH 3 •H 2 O )
1. С водой образуется аммиачная вода (нашатырный спирт), обладающий основными свойствами – фенолфталеин в таком растворе окрашивается в малиновый цвет, а красная лакмусовая бумага – в синий:
NH 3 + H 2 O ↔ NH 4 OH ↔ NH 3 •H 2 O ↔ NH 4 + + OH —
NH 3 +HCl = NH 4 Cl
NH 3 +H 2 SO 4 = NH 4 HSO 4 – гидросульфат аммония
2NH 3 +H 2 SO 4 = (NH 4 ) 2 SO 4 – сульфат аммония
Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH 3 . Огромные количества аммиака далее используются для получения азотной кислоты , которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин . Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон , например, нейлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка . В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Источник
Аммиак его способы получения
Ключевые слова конспекта: аммиак, строение молекулы, свойства, соли аммония, запах аммиака, гипс, азотная кислота, мочевина.
СТРОЕНИЕ МОЛЕКУЛЫ АММИАКА,
ЕГО ФИЗИЧЕСКИЕ СВОЙСТВА
Водородным соединением азота является аммиак NH3. Аммиак – вещество молекулярного строения. Его электронная и графическая формулы изображены на рисунке.
В молекуле NH3 тип химической связи – ковалентный полярный. Электронная плотность смещена к атому азота, на атоме азота – частичный отрицательный заряд δ – , на атомах водорода – частичный положительный заряд δ + .
В молекуле аммиака одинарные связи, так как на атоме азота в молекуле NH3 имеется неподелённая электронная пара. Выступая в качестве донора электронной пары, атом азота может участвовать в образовании по донорно–акцепторному механизму четвёртой ковалентной связи с другими атомами или ионами, обладающими электроноакцепторными свойствами. Именно поэтому аммиак реагирует с кислотами. Молекула аммиака способна присоединять протон (или ион гидроксония). При этом возникает четвёртая ковалентная связь с атомом водорода по донорно–акцепторному механизму. В результате образуется ион аммония:
При обычных условиях аммиак – бесцветный газ с резким характерным раздражающим запахом. Aммиaк легче воздуха.
Аммиак кипит при температуре –33,3 °С, его температура плавления –77,7 °С. Аммиaк легко сжижается при охлаждении и повышении давления. Он обладает чрезвычайно высокой растворимостью в воде: в одном объёме воды растворяется около 1200 объёмов аммиака при 0 °С, а при +20 °С – 700 объёмов. Разбавленные растворы аммиака (3–10%) называются нашатырным спиртом, концентрированные растворы (18,5–25%) – аммиачной водой.
При работе с аммиаком надо помнить, что даже незначительное содержание его приводит к раздражению слизистой оболочки носа, горла и т. д.
ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА
Рассмотрим химические свойства аммиака с позиций окислительно-восстановительных и кислотно-основных взаимодействий.
В молекуле аммиака азот находится в низшей степени окисления (–3), поэтому за счёт азота аммиак обладает только восстановительными свойствами.
Если пропустить ток аммиака по трубке, вставленной в другую широкую трубку, по которой проходит кислород, то аммиак можно зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется свободный азот:
В присутствии катализатора (сплав Pt и Rh) NH3 окисляется кислородом с образованием NO:
Этот процесс является одной из стадий промышленного получения азотной кислоты.
Аммиаком можно восстановить некоторые неактивные металлы или металлы средней активности из их оксидов:
В кислотно-основных взаимодействиях аммиак проявляет основные свойства. Он взаимодействует с кислотами с образованием солей аммония:
При растворении аммиака в воде устанавливается следующая совокупность равновесных состояний:
Поэтому водные растворы аммиака имеют щелочную реакцию.
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АММИАКА
Промышленным способом получения аммиака является его синтез из азота и водорода:
Сырьём является азот, полученный перегонкой жидкого воздуха, и водород, чаще всего получаемый разложением природного газа. Оптимальные условия проведения реакции: t° ≈ 500 °С, р ≈ 1000 атм, катализатор – губчатое железо с добавками (промоторами) К2O, Al2O3. В таких условиях выход аммиака составляет около 50%.
Лабораторным способом получения аммиака является взаимодействие солей аммония со щелочами при нагревании:
Эта реакция также является качественной реакцией на ион аммония. Её признак – появление запаха аммиака.
Образовавшийся аммиак хорошо растворяется в воде. Для получения аммиака в лаборатории лучше брать сульфат аммония и гидроксид кальция, тогда образующийся сульфат кальция связывает воду, образуется гипс – CaSO4 • 2H2O. Иногда вместо щёлочи используется натронная известь – смесь СаО и NaOH. Реакцию ведут при нагревании:
(NH4)2SO4 + Са(ОН)2 = CaSO4 + 2NH3↑ + 2H2O
Аммиак применяется для получения азотной кислоты HNO3, мочевины (H2N–СО–NH2) – ценного удобрения, для получения соды (Na2CO3) по аммиачному методу, для аминирования органических веществ. Жидкий аммиак и его водные растворы используются как жидкие удобрения. Аммиак применяется как хладагент в холодильниках (NH3 легко сжижается, а затем испаряется с поглощением большого количества теплоты). В медицине используется 10%-й раствор – нашатырный спирт.
СОЛИ АММОНИЯ
Соли аммония, как и другие соли, являются ионными соединениями, образованными катионами аммония NH4 + и анионами кислотных остатков. По многим свойствам соли аммония похожи на соли натрия и калия. При обычных условиях это твёрдые кристаллические вещества, бесцветные, если анион кислотного остатка не обусловливает какую–либо окраску.
Соли аммония разлагаются при нагревании. Состав продуктов реакции термического разложения зависит от природы кислотного остатка (аниона):
а) если соль аммония образована летучей кислотой и её анион не является сильным окислителем, то такая соль полностью разлагается с образованием соответствующих газов:
б) если в состав соли аммония входит анион, обладающий окислительной способностью, то при нагревании происходит окислительно–восстановительная реакция. Так, при нагревании нитрата или нитрита аммония происходит конпропорционирование (в результате степени окисления азота «сходятся»):
А нагревание дихромата аммония приводит к образованию оксида хрома(III), эту реакцию часто используют для имитации «вулканчика»:
Соли аммонию реагируют со щелочами с образованием аммиака:
Данную реакцию можно рассматривать как качественную на наличие ионов аммония. При нагревании аммиак улетучивается за счёт уменьшения его растворимости. Это легко определяется по характерному запаху аммиака и по окрашиванию влажной лакмусовой бумаги в синий цвет.
Конспект урока «Аммиак. Соли аммония».
Источник