Аммиачный способ производства кальцинированной соды
Производство кальцинированной соды
Абсорбция хлористого водорода водой
Абсорбцию проводят в скрубберах. Газ и вода подаются противотоком. Про-цесс идет с выделением тепла. Если тепло не отводить, невозможно получить соляную кислоту с концентрацией более 20%. Поэтому в абсорберах устанав-ливают холодильники, что позволяет получить соляную кислоту с концентра-цией более 30 %.
Существует несколько видов соды:
— двууглекислая или пищевая NaНCO3;
В наибольших масштабах используется кальцинированная сода – в ме-таллургии, ЦБП, в производстве стекла и др.
Аммиачный способ производства кальцинированной соды был разрабо-тан в конце XIX века русским химиком П.П. Федотьевым.
Сырьем для производства кальцинированной соды служат известняк, хлорид натрия и аммиак. Теоретические основы производства соды
Суммарная реакция имеет следующий вид:
Эта реакция идет в несколько стадий, которые протекают при последователь-ном насыщении раствора хлорида натрия аммиаком (аммонизация), а затем углекислым газом (карбонизация).
Стадия аммонизации необходима для введения в концентрированный раствор хлорида натрия углекислого газа, который практически не растворим в кон-центрированном растворе хлорида натрия.
Карбонизация идет в две стадии:
Далее идет обменное разложение:
Реакция (г) является основной стадией аммиачно-содового процесса и выход основного продукта определяется условиями ее равновесия. Наименее растворимым компонентом является NaHCO3 . В данных условиях он начинает кристаллизоваться. Кристаллы бикарбоната натрия отфильтровывают и прока-ливают. При этом бикарбонат разлагается:
Образовавшийся углекислый газ вновь используют для карбонизации аммиач-ного раствора. Для восполнения потерь углекислого газа используют газы, об-разовавшиеся при обжиге известняка:
Обжиг проводят в шахтных пересыпных печах с воздушным дутьем при тем-пературе в зоне обжига 1100-1200 0 С. В качестве топлива используют уголь. Содержание углекислого газа в образовавшихся газах около 40 %.
Полученная при обжиге известняка известь идет на приготовление из-весткового молока:
Известковое молоко необходимо для регенерации аммиака из маточного раствора (фильтровой жидкости), полученного после отделения бикарбоната натрия. Регенерацию проводят дистилляцией фильтровой жидкости, смешан-ной с известковым молоком:
Регенерированный аммиак применяется для аммонизации раствора хло-рида натрия, хлорид кальция является отходом данного производства.
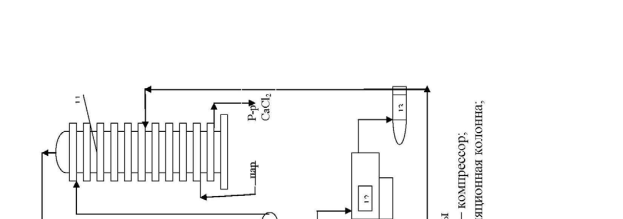
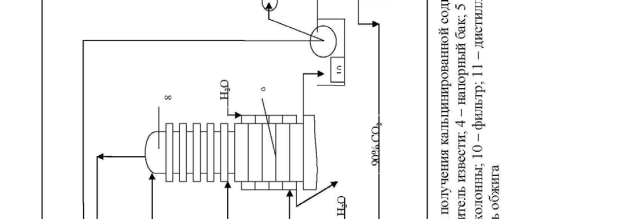
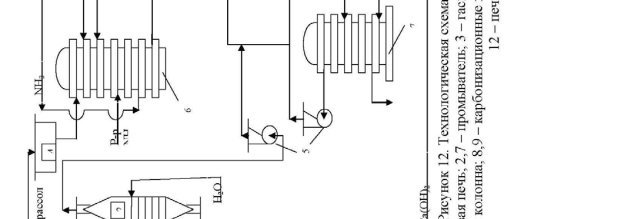
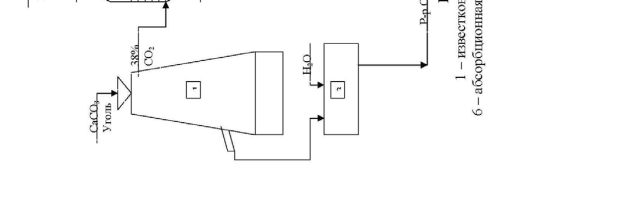
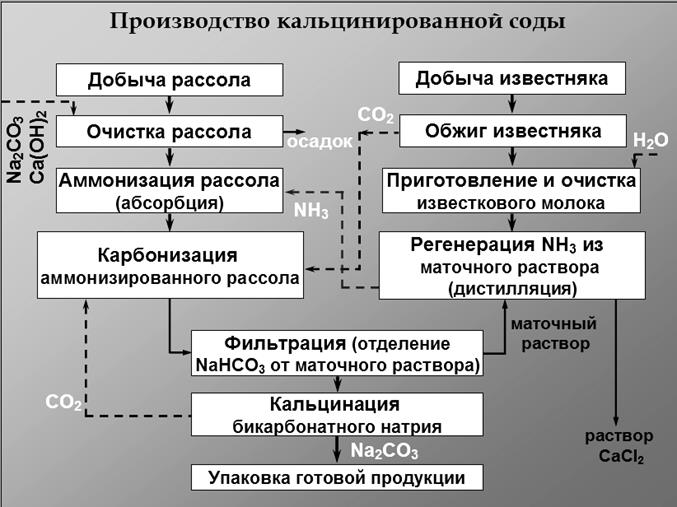
Технологическая схема производства кальцинированной соды.
Технологическая схема производства кальцинированной соды аммиач-ным способом представлена на рис.12. Для производства соды используют очищенный раствор хлорида натрия с концентрацией 270 г/л. Он поступает из напорного бака 4 в абсорбционную колонну барботажного типа 6, где проис-ходит насыщение рассола аммиаком и частично углекислым газом. Для этого используют регенерированный аммиак из дистиляционной колонны 11, а так-же отходящие газы карбонизационных колонн 8 и фильтров 10, содержащие небольшое количество аммиака и углекислого газа.
Абсорбция ведется последовательно в нескольких абсорберах. Для ком-пенсации потерь аммиака в абсорберы вводится аммиачная вода (примерно 2,5 кг на 1 т воды). Затем аммонизированный рассол подается в карбонизацион-ные колонны 8. В нижней части которых 9 расположены холодильники, в ко-торых циркулирует холодная вода.
В нижнюю и среднюю части колонны компрессорами 5 подается концен-трированный углекислый газ из печи обжига 12 и слабый печной газ из
вестковых печей 1. В результате карбонизации образуется бикарбонат натрия в виде твердой фазы. Бикарбонатная суспензия из колонны 9 подается на ваку-ум-фильтр барабанного типа 10, где суспензия делится на сырой бикарбонат и фильтровую жидкость. Сырой бикарбонат подается в печь обжига 12 , темпе-ратура в которой составляет 140-170 0 С. Образовавшаяся сода удаляется из пе-чи шнеком и транспортером 13 подается на упаковку.
Газы кальцинации, содержащие водяные пары и 90 % СО2 в сухом газе удаляют с загрузочного конца печей и после охлаждения и промывки водой в промывателе 7 компрессором 5 подают на карбонизацию.
Фильтровая жидкость с фильтра 10 подается на регенерацию аммиака в дистиляционную колонну 11. Туда же подается известковое молоко из гасите-ля 3. В нижнюю часть колонны подается пар. Из нижней части дистиляцион-ной колонны отводится раствор хлорида кальция в шламовые бассейны, а газы дистилляции после охлаждения подаются в абсорбер 6.
Известь и газ, содержащий 30-35 % СО2 производятся в известковых пе-чах 1. Образующийся там печной газ очищают от пыли и охлаждают в промы-вателе 2 и компрессорами 5 подают на карбонизацию в колонну 8.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Производство кальцинированной соды аммиачным способом. Химизм процесса. Основные и вспомогательные стадии процесса. Цикл использования аммиака в процессе.
Сырьем для производства кальцинированной соды аммиачным методом является поваренная соль в виде насыщенного водного раствора (рассола), с концентрацией около 300 г/л, и известняк (мел) – СаСО3. В качестве вспомогательного вещества применяют аммиак.
Сразу превратить NаС1 в соду невозможно, т.к. в NaCl нельзя заменить непосредственно ион сильной соляной кислоты на ион слабой уксусной кислоты. Поэтому соду получают через промежуточное соединение (бикарбонат натрия).
Хлорид натрия перерабатывается в соду путем реакции обмена, происходящей в водном растворе между двумя солями. При этом одна из образующихся солей хорошо растворима в воде, а вторая — плохо и может быть выделена из раствора в виде твердого осадка. Задача состоит в том, чтобы подобрать вторую соль, плохо растворимую в воде. Такой солью может быть бикарбонат натрия – NаНСО3. Для получения NаНСО3 проводят обменную реакцию между NaCl, находящимся в растворе, и также хорошо растворимой кислой углекислой солью аммония (бикарбонатом аммония):
Углекислый аммоний не изготовляется отдельно, а получается во время самого процесса насыщением соляного раствора сначала аммиаком (аммонизация раствора) а потом углекислым газом (карбонизация раствора):
Реакция (9.1) обратима. Степень превращения NaCl составляет 70-75% и зависит от температуры и концентрации реагирующих веществ. Полученный NаНСО3 выделяется из раствора в кристаллическом виде, а его кристаллы отделяют от раствора фильтрацией.
Полученный NаНСО3 превращают в карбонат натрия при высокой температуре:
Этот процесс называется кальцинацией.
Получение бикарбоната и карбоната натрия являются основными процессами в производстве. Наряду с этим проводят и ряд вспомогательных операций, к которым относятся получение углекислого газа и аммиака, необходимых для превращения раствора NаС1 в соду»
Углекислый газ получают обжигом известняка:
При этом получается и обожженная известь (СаО), которая также находит применение в содовом производстве. Выделившейся по реакциям (9.3) и (9.4) СО2 направляется на карбонизацию содового раствора.
Аммиак получают обработкой раствора NН4С1, образующегося по реакции (9.1) и находящегося в растворе после отделения кристаллического NаНСО3. Раствор нагревают с известковым молоком (гашеной известью, смешанной с водой):
Необходимую для реакции гашеную известь получают при действии на обожённую известь, полученную по реакции (9.4), водой:
Полученный по реакции (9.5) аммиак направляется на насыщение соляного раствора (аммонизацию) — реакция (9.2). Т.о. аммиак совершает в производстве замкнутый цикл — вступает в реакцию с NаС1, образовав NН4НСОз путем реакции (9.2),а затем выделятся при разложении NH4С1 по реакции (9.5). Поэтому количество аммиака во время всего процесса должно оставаться постоянным. Свежий аммиак добавляется только для компенсации потерь.
Вопрос № 29
Блок-схема процесса производства кальцинированной соды аммиачным способом. Тенденции развития содового производства.
Развитие содовой промышленности связано с использованием отходов производства – CaCl2, и мелких фракций мела или известняка. Промышленное применение получил процесс производства соды из мирабилита – Na2SO4 с одновременным получением сульфата аммония (удобрения). Предлагается получать соду без регенерации аммиака из раствора NH4C1, выделяя хлористый аммоний из раствора и используя его как удобрение.
Предлагается применение в качестве сырья вместо NaCl сильвинита (КС1* NaCl), что позволит получать соду и азотнно-калийное удобрение (КС1 + NH4C1). Суть такого процесса заключается в карбонизации хлоридов натрия и кадия в присутствии не аммиака, а органических аминов, например гексаметилендиамина:
Отфильтровав затем бикарбонат, его направляют в печь кальцинации, где получают соду и поташ. Фильтрат регенерируют в катодной камере электролизера, где и получают нейтральную солянокислую соль амина. Далее раствор подщелачивается и нейтрализует солянокислую соль, а амин можно использовать вновь.
Вопрос № 30
Производство едкого натра и хлора электрохимическим способом. Электролиз хлоридов натрия в ваннах с фильтрующей диафрагмой. Блок-схема промышленного производства едкого натра и хлора.
К электрохимическим производствам относят химические процессы, протекающие в водных процессах или расплавах под действием постоянного электрического тока. Путем электролиза возможно получение химических продуктов высокой чистоты. К недостаткам электролитических процессов следует отнести высоких расход энергии при электролизе, что увеличивает себестоимость получаемых продуктов. Оценить эффективность электрохимического процесса позволяет выход по току (η 

Практически в современных ваннах выход по току составляет 94-97%.
При электролизе помимо основного процесса, протекает ряд побочных, также связанная с затратами энергии. Мерой эффективности использования энергии при электролизе служит коэффициент использования энергии (μ), который равен отношению количества энергии, теоретически необходимой для выделения единицы продукта (Wт), к действительно затраченной (Wпр):
μ= (Wт/ Wпр)*100%; μ=(Vr/Vпр)*η где: Vт- теоретическое напряжение на электролизе, В; Vпр- практическое напряжение в ванне В. На практике всегда стремятся иметь максимальный коэффициент использования энергии. Для этого создают условия, при которых напряжение в ванне невелико, выход по току большой.
Электролиз хлоридов натрия в ваннах с фильтрующей диафрагмой.
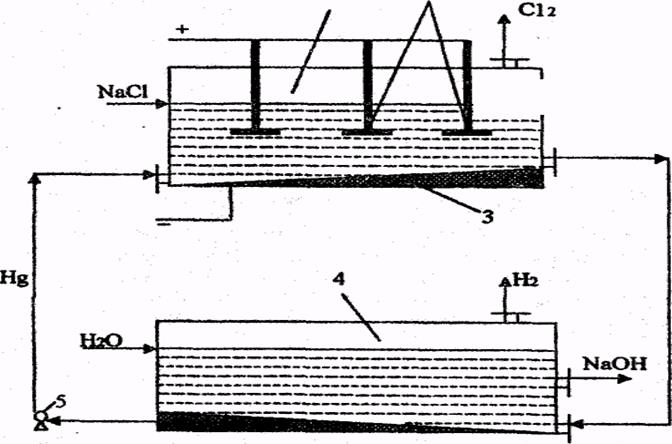
Ванна с фильтрующей диафрагмой изображена на рис. 10.1. Она представляет собой цилиндрический сосуд (1), внутри которого находится асбестовая диафрагма (2) железный катод (3) в виде сетки и графитовый анод (4).
В водном растворе NaCl диссоциирован на ионы Na + и Cl — . Вода, хотя и слабо, но также диссоциирована на ионы Н + и ОН — . При пропускании постоянного электрического тока на аноде происходит разряд ионов хлора и образуются молекулы газообразного хлора:
На катоде разряжаются ионы водорода:
и выделяется водород.
Ионы гидроксила и натрия образуют едкий натр:
Na + + OH — = NaOH (10.8)
Подготовленный раствор NaCl подается в анодное пространство (5) ванны, где при прохождении электрического тока при температуре около 80 0 С происходит выделение Сl2 на аноде. Раствор хлорида натрия фильтруется через диафрагму (2) водород в катодном пространстве (6) выделяется на катоде и выводится из катодного пространства. Образовавшийся NаОН вместе с неразложившейся поваренной солью стекает на дно катодного пространства и выводится из нижней части ванны. Этот раствор, называемый электролитическим щелоком, имеет
Ванна с фильтрующей диафрагмой изображена на рис. 10.1. Она представляет собой цилиндрический сосуд (1), внутри которого находится асбестовая диафрагма (2) железный катод (3) в виде сетки и графитовый анод (4).
В водном растворе NaCl диссоциирован на ионы Na + и Cl — . Вода, хотя и слабо, но также диссоциирована на ионы Н + и ОН — . При пропускании постоянного электрического тока на аноде происходит разряд ионов хлора и образуются молекулы газообразного хлора:
На катоде разряжаются ионы водорода:
и выделяется водород.
Ионы гидроксила и натрия образуют едкий натр:
Na + + OH — = NaOH (10.8)
Подготовленный раствор NaCl подается в анодное пространство (5) ванны, где при прохождении электрического тока при температуре около 80 0 С происходит выделение Сl2 на аноде. Раствор хлорида натрия фильтруется через диафрагму (2) водород в катодном пространстве (6) выделяется на катоде и выводится из катодного пространства. Образовавшийся NаОН вместе с неразложившейся поваренной солью стекает на дно катодного пространства и выводится из нижней части ванны. Этот раствор, называемый электролитическим щелоком, имеет следующий состав: NaOH-110- 120 г/л, NaCl- 170-180 г/л.
На переносе тока от катода к аноду наряду с ионом С1 — принимает участие и ОН — -ион: он либо реагирует с растворенным в электролите хлором (Cl2) либо непосредственно разряжается на аноде, образуя кислород. Материал анода (графит) взаимодействует с кислородом в момент его выделения по реакции:
При этом наряду с химическим взаимодействием происходит и механическое разрушение анода. Т.о. в результате побочных процессов выход по току падает, усиливается износ анодов, увеличивается содержание О2 и СО2 в хлоре. Чтобы уменьшить участие ОН — -ионов в переносе тока и связанные с эти нежелательные процессы, устанавливают обратный поток электролита из анодного в катодное пространство через диафрагмы — фильтрующие перегородки. Диафрагма предотвращает контакт выделяющегося хлора с водородом или с одновременно образующейся щелочью.
Диафрагмы в современных электролизерах изготовляются из асбестового волокна или асбестовой бумаги. Их толщина составляет 1-1,5 мм. Они непосредственно примыкают к катоду, представляющему собой перфорированный стальной лист или стальную сетку.
Для увеличения нагрузки на ванну (силы питающего тока) и повышения еёпроизводительности стремятся в данном объеме ванны получить возможно более развитую поверхность катода и диафрагмы и полнее использовать поверхность анода. Это приводит к усложнению формы катода. С усложнением конфигурации катода становится затруднительным нанесение на него асбестового картона. В этом случае наносят диафрагму насасываннем её на сложную поверхность катода из суспензии (взвеси) асбестового волокна в соляном растворе. Используются также асбополимерные диафрагмы. Такого типа ванны называют ваннами с осажденной диафрагмой. Срок службы диафрагмы составляет от 0,8 до 1,4 лет.
рис. 10.1 Ванна с фильтрующей диафрагмой:
1 – цилиндрический сосуд;
2 – асбестовая диафрагма;
3 – железный катод;
4 – графитовый анод;
5 – анодное пространство;
6 – катодное пространство.
Вопрос № 31
Производство едкого натра и хлора электрохимическим способом. Электролиз хлоридов натрия в ваннах с ртутным катодом. Блок-схема промышленного производства едкого натра и хлора. Основные показатели процесса электролиза.
См. вопрос 30.
хлоридов натрия в ваннах с ртутным катодом. Ванна с ртутным (жидким) катодом изображена на рис. 10.2 и состоит из двух частей — электролизера и разлагателя, соединённых друг с другом. Электролизер (1) представляет собой длинный закрытый ящик. В него опущены графитовые аноды (2) катодом служит ртуть (З) которая течёт по слегка наклонному дну ванны. Раствор NaСl концентрацией 310-315 г/л непрерывно подается в электролизер. При прохождении постоянного тока на анодах выделяется хлор по реакции (10.6). На ртутном катоде перенапряжение выделения водорода очень велико и Н + -ионы не разлагаются; а происходит разряд ионов натрия, т.к. потенциал выделения натрия на ртутном катоде значительно ниже потенциала выделения водорода и незначительно возрастает при увеличении плотности тока. В результате образуется натрий:
Na + + e = Na (10.10)
который реагирует со ртутью, образуя амальгаму натрия;
Na + nHg = NaHgn (10.11)
Температура электролита 70-80 0 С. Из верхней части электролизера непрерывно выводится обедненный раствор NaCl (около 270 г/л), а снизу — амальгама натрия, которая поступает в разлагатель (4), где она обрабатывается водой. При этом происходит образование NaOH, водорода и ртути:
NaHgn + Н2O = NaOH + 0,5 Н2O + nHg (10.12)
Амальгама натрия разлагается на специальных насадках из соединений различных металлов (цирконий, вольфрам). Выделившуюся ртуть с помощью насоса (5) возвращают в электролизер. Таким образом, ртуть находится в замкнутом цикле (электролизер — разлагатель — электролизер). Обедненный раствор NaCl донасыщают хлоридом натрия и вновь возвращают на электролиз. Из разлагателя выводится раствор очень чистой щелочи.
Рис. 10.2. Ванна с ртутным катодом:
1 — электролизер; 2 — графитовые аноды; 3 — ртутный катод; 4 — разлагатель; 5 — насос
Преимущества ванны с ртутным катодом — высокая концентрация полученной щелочи, что уменьшает расход топлива на её упаривание, и высокая степень чистоты получаемой щелочи. Недостатками этих ванн по сравнению с ваннами с фильтрующей диафрагмой является повышенный расход энергии на единицу продукции (табл. 10.1); значительные капитальные затраты на строительство ванн; необходимость большого количества ртути, вредные условия труда, возможность попадания ртути в
окружающую среду, образование вредных отходов. Расход ртути составляет 0,7 кг/т хлора, т.к. имеет место образование различных ртутьсодержащих отходов. Неконтролируемые выделения хлора составляют 1-5 т хлора на 100 т производимого хлора при диафрагменном методе производства и 2-8 т хлора при ртутном методе.
Несмотря на перечисленные недостатки, применение ванн с ртутным катодом возрастает, т.к. многие производства требуют чистой щелочи, не содержащей хлоридов.
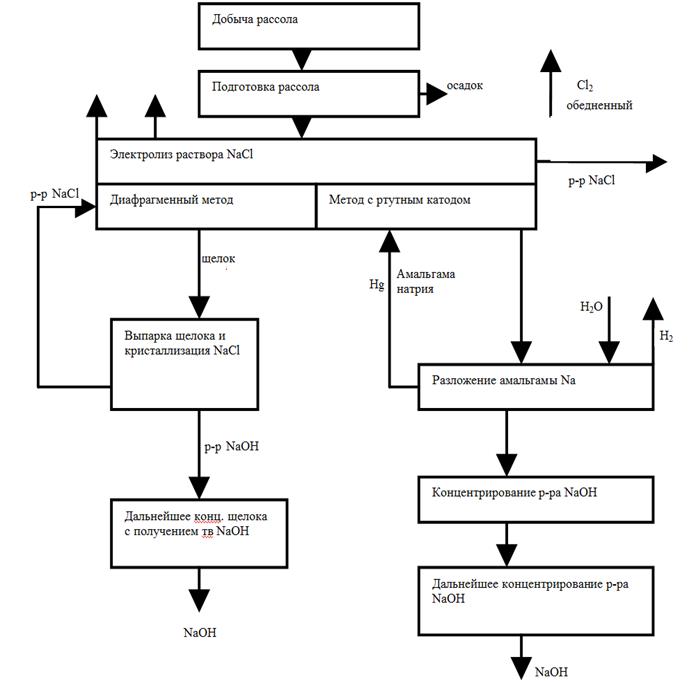
Недостатком диафрагменного метода является необходимость применения стадии выпарки щелока с отделением соли. Растворы щелочи, полученные из как ванн с фильтрующей диафрагмой, так и из разлагателей ванн с ртутным катодом, подвергают упариванию вначале в вакуум-выпарных аппаратах, а затем в котлах до концентрации NaOH 92-94%. При этом в случае концентрирования щелоков из ванн с фильтрующей диафрагмой, которые содержат не только NaOH, но и NaCl, при их упаривании происходит кристаллизация NaCl. Однако, несмотря на использование многоступенчатого процесса, полностью удалить NaCl не удается, поэтому едкий натр содержит в качестве примеси 2-3% NaCl. Хлорид натрия, выделяющийся при упаривании щелоков, возвращают в электроизёр. Процесс упаривания примерно на 30% удорожает себестоимость каустической соды диафрагменным методом. Блок-схема процессов производства NaOH, хлора и водорода представлена на рис. 10.3.
Крупнейшие установки в мире, работающие по диафрагменному методу, имеют мощность 1000-1300 т/сутки каустической соды.
Хлор, получений при электролизе, насыщен водяными парами. Его в ряде случаев перерабатывают в жидкий хлор. При этом сначала путём охлаждения из газообразного хлора удаляется влага (конденсация). Затем для окончательной осушки его подают в башни,
орошаемые концентрированной серной кислотой. Хлор переводят в жидкое состояние при сжатии до 0,3-0,6 МПа и охлаждением до – 25 0 C.
Источник