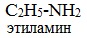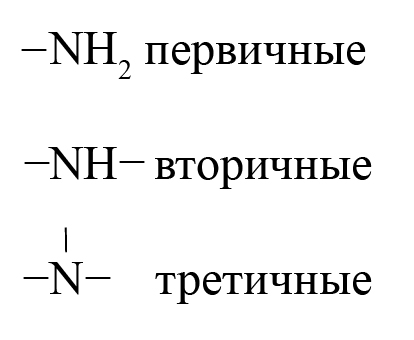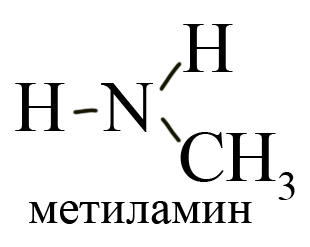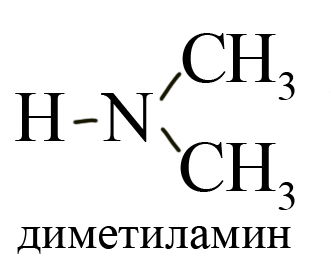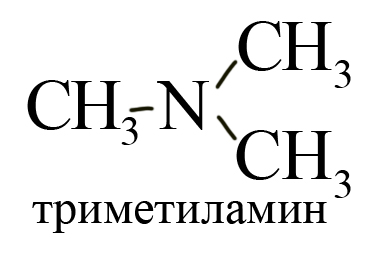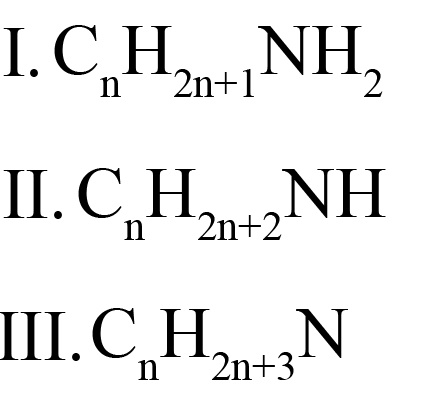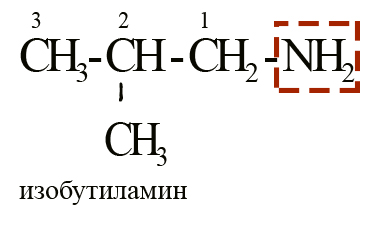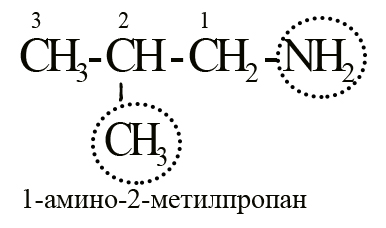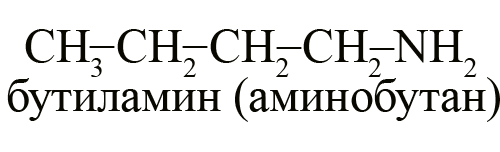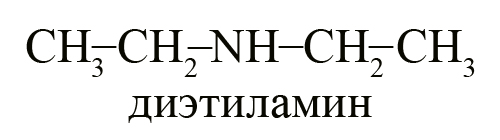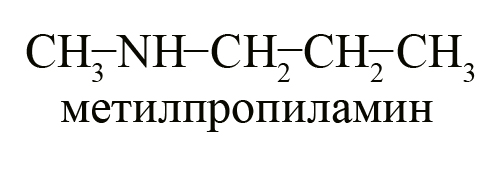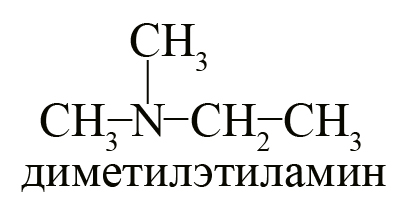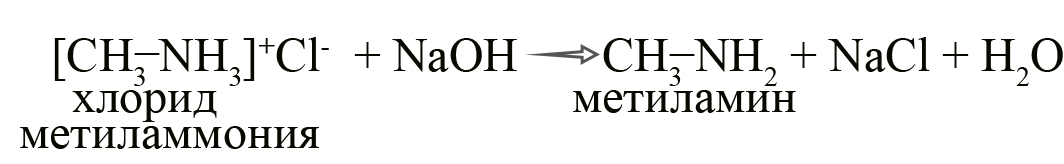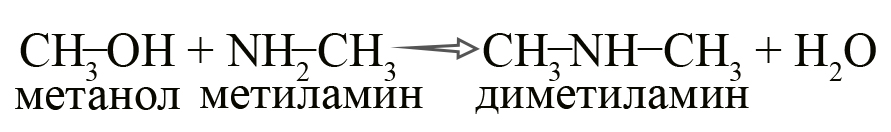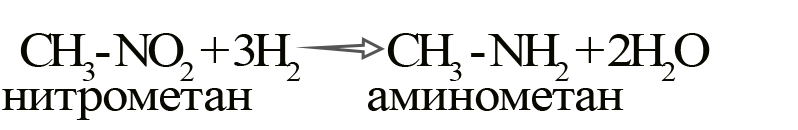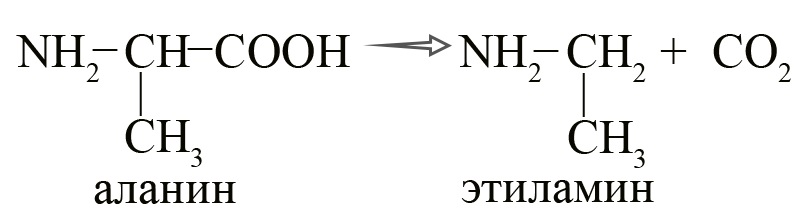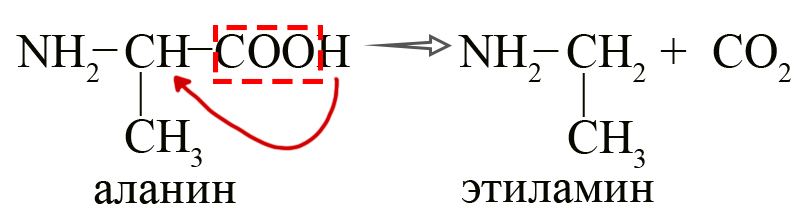Амины классификация номенклатура способы получения
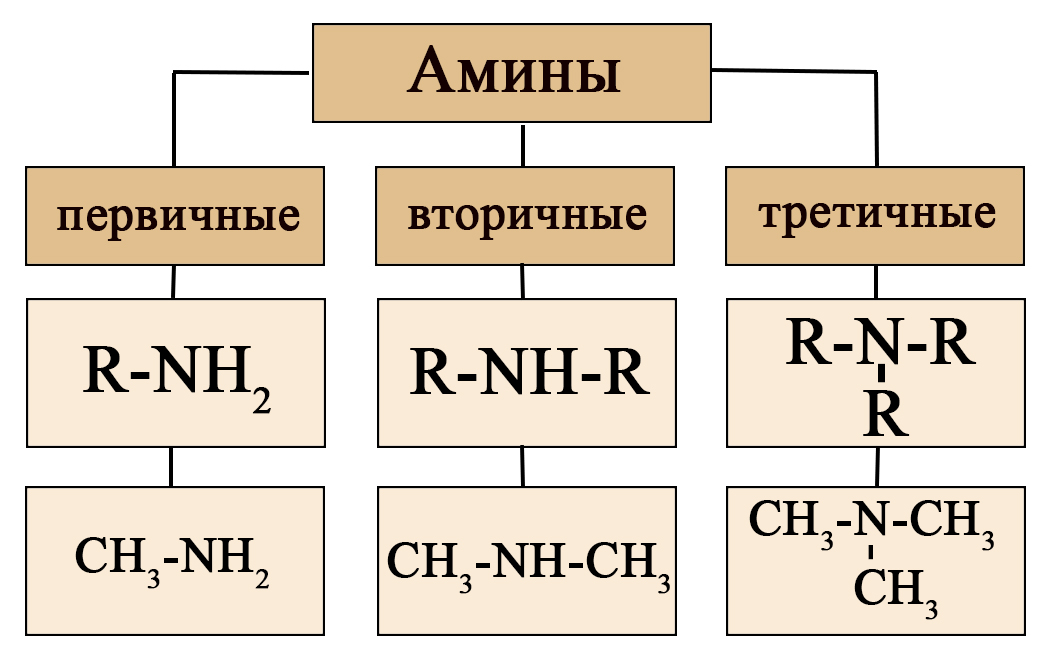
Амины классифицируют по трем структурным признакам.
I. По числу углеводородных радикалов в молекуле амина.
II. По природе (строению) углеводородного радикала.
III. По числу аминогрупп в молекуле.
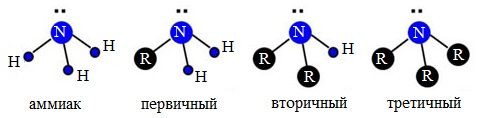
I. В зависимости от того, сколько атомов водорода замещено углеводородными радикалами в молекуле NH3, различают амины:
— первичные R-NH2 – содержат аминогруппу (-NH2). Первичные амины можно также рассматривать как производные углеводородов, в которых атом водорода замещен на аминогруппу -NH2).
— вторичные R-NH-Rʹ — содержат иминогруппу (-NH)
— третичные R-N-Rʹ — содержат атом азота
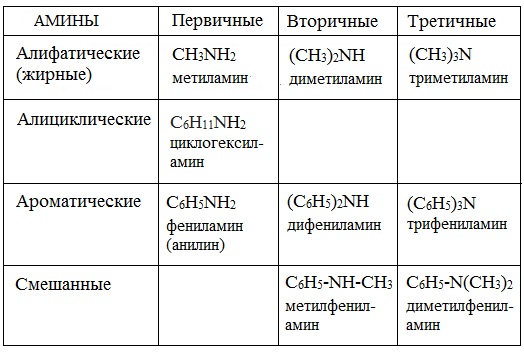
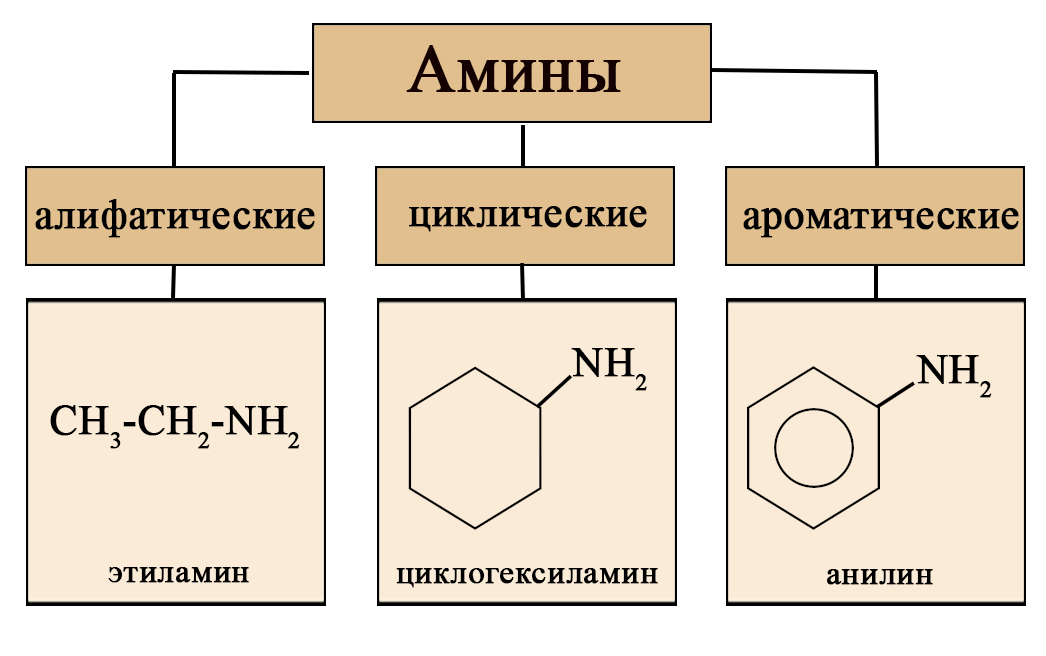
II. В зависимости от природы углеводородных радикалов, амины могут быть алифатическими (предельными и непредельными), алициклическими, ароматическими или смешанными(атом азота связан с алифатическим и ароматическим радикалами).
III. По числу аминогрупп в молекуле амины делят на моноамины СH3 – NН2, диамины H2N (СH2) 2NН2, триамины и т.д.
Диамины – это органические соединения, содержащие две аминогруппы — NH2. Например:
H2N- (CH2)6-NH2, гексаметилендиамин (применяется для получения синтетического волокна нейлона).
Кроме того, к аминам относятся азотсодержащие циклы, в которых атом азота связан с углеродными атомами. Например, уротропин может рассматриваться как третичный амин.
Источник
Амины
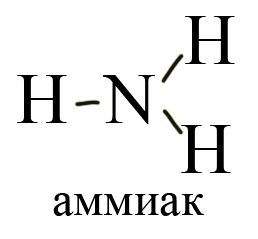
Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная группой аминов является аминогруппа — NH2.
Классификация аминов
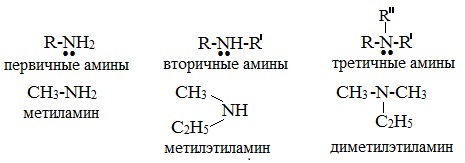
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).
Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
Получение
- Нагревание галогеналканов с аммиаком
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.
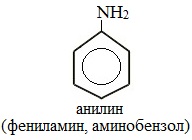
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.
Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон.
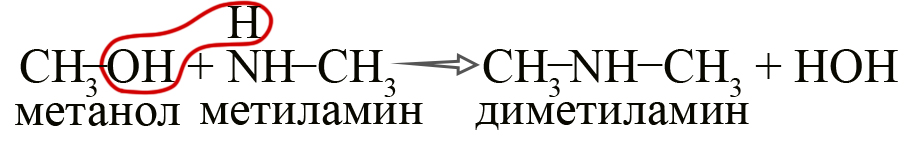
В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
Химические свойства аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.
Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.
Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».
Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Амины классификация номенклатура способы получения
Селивёрстова Алиса Андреевна
- alisa@onlineclass.spaceГруппа ВКонтактеBioChem Сhannel
- Profi.RU
- Яндекс.Дзенportfoliosite.comgithub.com/username@twittername —>
Подготовка к:
OnLine
Материал по химии
- Определение и классификация
Амины – предельные органические вещества, содержащие аминогруппу, которая, в зависимости от амина может иметь следующий вид:
Эту группу можно рассматривать как производные аммиака, в котором атомы водорода заместили на углеводородный радикал.
По количеству замещенных атомов водорода можно классифицировать амины на первичные (замещен только один атом водорода), например, метиламин:
Вторичные (замещены два атома водорода), например, диметиламин:
Третичные (замещены все три атома водорода), например, триметиламин:
Общая формула всех аминов CnH2n+3N, однако, если выделять аминогруппу, то общие формулы первичных, вторичных и третичных аминов будут отличаться: (I – у первичных, II – у вторичных, III – у третичных):
Так же амины можно классифицировать по характеру радикалов на алифатические (амины жирного ряда, содержащие в качестве радикала остаток предельного линейного углеводорода), циклические и ароматические.
- Номенклатура аминов
Номенклатура первичных аминов
При наименовании аминов чаще всего используется радикало-функциональная номенклатура органических веществ, особенно это характерно для вторичных и третичных аминов.
За основу берется аминогруппа, а всё, что с ней связано считается радикалом. Сначала дается наименование радикалу, а затем добавляется суффикс «-амин». Например, вещество с формулой CH3-CH2-CH2-NH2 можно назвать пропиламином. Представленный на рисунке изобутиламин можно назвать 2-метилпропиламином-1.
Есть и другие методы, которыми можно воспользоваться при наименовании амина, например, заместительная номенклатура. Для этого выделяется самая длинная углеводородная цепь, всё остальное, включая амино-группу, является радикалами-заместителями, которые перечисляют в алфавитном порядке с указанием их мест (номер атома углерода, которому принадлежит данный радикал). Таким образом изобутиламин можно назвать 1-амино-2-метилпропаном.
Номенклатура вторичных и третичных аминов
Для вторичных и третичных аминов характернее радикало-функциональная номенклатура, например:
- Изомерия аминов
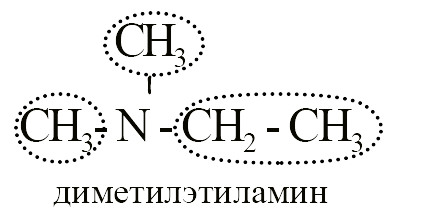
Первичные, вторичные и третичные амины с одинаковым количеством углерода являются изомерами друг другу, например, формуле C4H11N соответствуют следующие вещества:
- Бутиламин (1-аминобутан) – первичный амин.
- Два вторичных амина – диэтиламин и метилпропиламин.
- Один третичный амин – диметилэтиламин.
- Получение аминов
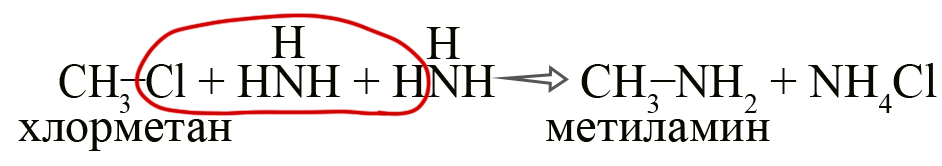
- Алкилирование аммиака галогеналканами (Реакция Гофмана). Одна из первых реакций, использованных для синтеза аминов. В настоящее время в промышленности не используется так как при этой реакции образуется не один необходимый амин, а смесь разных аминов и их солей. В лаборатории амины получают реакцией галогеналкана с избытком аммиака:
Чтобы легче запомнить данную реакцию, можно изобразить её следующим образом (не отображающим реального процесса):
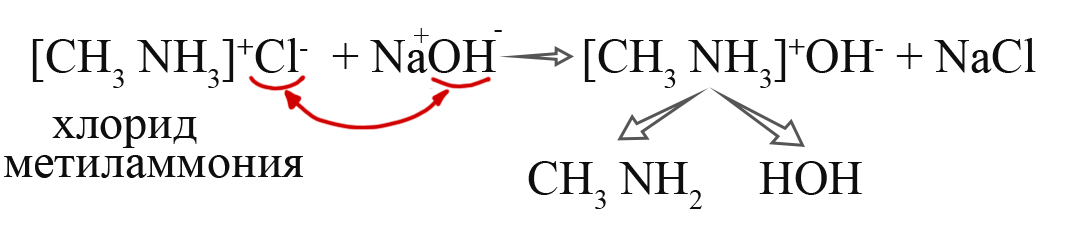
- Получение аминов из солей. При взаимодействии солей со щелочами происходит обменная реакция, при которой образуется гидроксид алкиламмония, разлагающийся как разлагается гидроксид аммония:
- Получение аминов из спиртов. Эта реакция осуществима в более жестких условиях – в присутствии Al2O3 и ThO2 при нагревании до 300ºС.
Эту же реакцию можно представить следующим образом:
- Получение аминов восстановлением нитросоединений. Нитросоединение обрабатывают водородом в присутствии катализаторов (Pt, Pd, Ni) при нагревании. Так же используют водород, полученный в момент его выделения из реакций кислоты с металлом (Fe + HCl) или щелочи с амфотерным металлом (Al + NaOH).
- Получение аминов из аминокислот путем их декарбоксилирования (потерей CO2) в присутствии ферментов.
Процесс можно представить следующим образом:
Источник