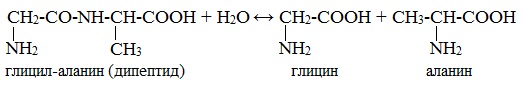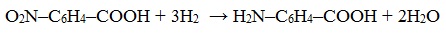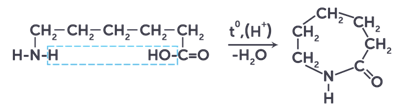- Аминокислоты способы получения гидролиз
- Аминокислоты способы получения гидролиз
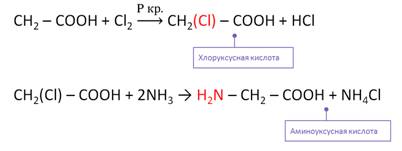
- 1. Из карбоновых кислот через их галогенопроизводные в радикале
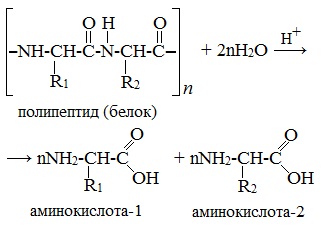
- 2. Гидролиз пептидов и белков
- 3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот)
- 4. Микробиологический синтез
- Аминокислоты: свойства и получение
- Урок 37. Химия 10 класс (ФГОС)
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Аминокислоты: свойства и получение»
- Биотехнология получения аминокислот, витаминов, метаболитов
- 3.1. Производство аминокислот
Аминокислоты способы получения гидролиз
Для синтеза α-аминокислот используют несколько основных подходов. Первый основан на замещении атома водорода α-положения карбоновой кислоты на аминогруппу через стадию галогенпроизводного. Галогенкарбоновую кислоту обычно получают по методу Геля-Фольгарда-Зелинского, затем проводится аминирование действием аммиака, либо, по Габриэлю, через N-алкилфталимид.
Другой распространенный метод синтеза заключается в гидролизе нитрильной группы цианаминов, которые легко получаются присоединением цианида калия и аммиака к карбонильным соединениям (метод Штрекера). Эта реакция имеет общее значение, т.к. цианамины могут быть получены практически из любых альдегидов и кетонов, т.е. данный метод позволяет синтезировать аминокислоты с самыми разнообразными заместителями.
Третий способ получения α-аминокислот – восстановительное аминирование α-оксокислот. Действием аммиака или гидроксиламина на α-оксокислоты получают соответствующие имины или оксимы, которые восстанавливают водородом в присутствии палладиевого катализатора.
Синтез аминокислот на основе малонового эфира многостадиен и включает в себя стадии нитрозирования, восстановления нитрозомалонового эфира до аминомалонового эфира, алкилирования, гидролиза образовавшегося аминоалкилмалонового эфира и его декарбоксилирования. Тем не менее, этот способ активно применяют, особенно для синтеза полифукциональных аминокислот. Например, ниже приведен способ получения этим методом лизина.
Существуют методы синтеза α-аминокислот, исходя из простейшей аминокислоты – глицина:
Все основные способы получения β-аминокислот используют в качестве исходных α,β-непредельные карбоксильные соединения. Так, присоединение аммиака к α,β-непредельным кислотам протекает против правила Марковникова и дает β-аминокислоты. Реакция α,β-непредельных кислот с галогенводородами приводит к β-галогенкарбоновым кислотам, которые при обработке аммиаком или фталимидом калия образуют β-аминокислоты.
Сложные эфиры α,β-непредельных дикарбоновых кислот, получаемые из малонового эфира и карбонильных соединений, присоединяют аммиак, давая сложные эфиры β-аминодикарбоновых кислот. Их гидролиз и последующее декарбоксилирование приводит к β-аминокислотам (способ Родионова).
Общий метод получения ω-аминокислот – гидролиз соответствующих лактамов, получаемых из циклических оксимов кетонов перегруппировкой Бекмана. Так в промышленности из циклогексаноноксима синтезируют капролактам, гидролиз которого дает ε-аминокапроновую кислоту.
орто-, мета— и пара-Аминобензойные кислоты получают восстановлением нитрогруппы в соответствующих нитробензойных кислотах. Ниже приведена схема синтеза этих соединений исходя их толуола.
Другой способ получения антраниловой кислоты заключается в расщеплении по Гофману моноамида фталевой кислоты.
Источник
Аминокислоты способы получения гидролиз
Большинство аминокислот можно получить в результате химических реакций или при гидролизе белков.
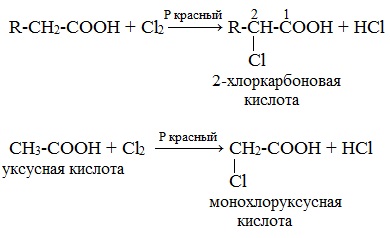
1. Из карбоновых кислот через их галогенопроизводные в радикале
Галогенирование карбоновых кислот
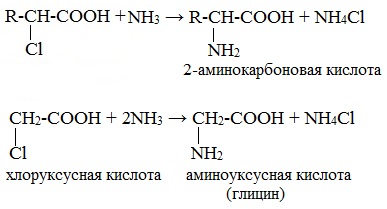
Взаимодействие α-галогенкарбоновых кислот с избытком аммиака (аммонолиз)
На второй стадии происходит замещение атома галогена в галогенкарбоновых кислотах на аминогруппу. Выделяющийся при этом хлороводород связывается избытком аммиака в хлорид аммония:
2. Гидролиз пептидов и белков
α-Аминокислоты образуются при гидролизе пептидов и белков.
При гидролизе белков обычно образуются сложные смеси α-аминокислот, однако с помощью специальных методов из этих смесей можно выделять отдельные чистые аминокислоты.
3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот)
4. Микробиологический синтез
Этот способ основан на способности специальных микроорганизмов вырабатывать в питательной среде в процессе жизнедеятельности определенную α-аминокислоту.
Источник
Аминокислоты: свойства и получение
Урок 37. Химия 10 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Аминокислоты: свойства и получение»
Рассмотрим физические свойства аминокислот. Аминокислоты – это бесцветные кристаллические вещества; имеют высокие температуры плавления, они хорошо растворимы в воде, но малорастворимы в органических растворителях. Аминокислоты бывают сладковатыми, горьковатыми и безвкусными. Аминокислоты хорошо кристаллизуются и имеют высокую плотность.
Получают α-аминокислоты из α-галогензамещённых карбоновых кислот при взаимодействии с аммиаком. Причём эту реакцию проводят в две стадии. Сначала получают α-галогензамещённую карбоновую кислоту, а на второй стадии при взаимодействии с аммиаком галоген замещается на аминогруппу.
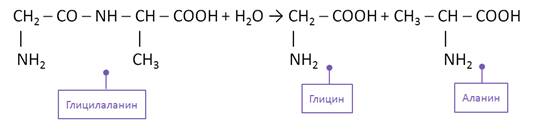
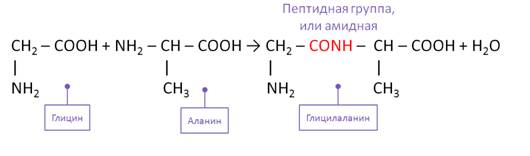
Второй способ получения аминокислот – это гидролиз полипептидов – белков. При этом получается смесь аминокислот. Например, при гидролизе глицил-аланина образуются аминокислоты глицин и аланин.
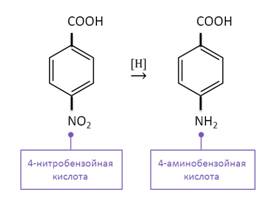
Ароматические аминокислоты получают при восстановлении нитропроизводных ароматических кислот по реакции Зинина. Так, при восстановлении 4-нитробензойной кислоты получается 4-аминобензойная кислота.
Аминокислоты можно получить и микробиологическим синтезом. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α-аминокислоты.
Так как аминокислоты – это бифункциональные соединения, у которых есть карбоксильная и аминогруппы, то для них характерны кислотно-основные свойства. Карбоксильная группа обуславливает кислотные свойства, а аминогруппа – основные. То есть аминокислоты обладают амфотерными свойствами.
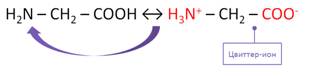
Для аминокислот характерна внутримолекулярная нейтрализация, при этом образуется биполярный, цвиттер-ион.
Аминокислоты электропроводны за счёт образования внутренних солей, при котором происходит перенос протона от карбоксильной группы к аминогруппе.
Рассмотрим химические свойства аминокислот по карбоксильной группе. Аминокислоты будут реагировать со щелочами. Так, в реакции глицина с гидроксидом натрия образуется натриевая соль 2-аминоуксусной кислоты и вода.
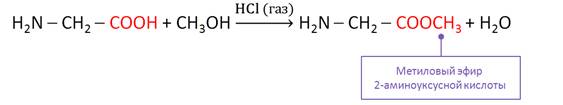
Аминокислоты реагируют со спиртами, при этом образуются сложные эфиры, которые представляют собой летучие вещества. Так, в реакции глицина с метанолом в присутствии газоообразного хлороводорода образуется сложный эфир – метиловый эфир 2-аминоуксусной кислоты.
В реакции аминокислот с аммиаком образуются амиды.
Рассмотрим химические свойства аминокислот по аминогруппе.
Аминокислоты реагируют с минеральными кислотами. Так, в реакции глицина с соляной кислотой образуется соль аминоуксусной кислоты.
Аминокислоты реагируют с азотистой кислотой подобно аминам, при этом образуется гидроксокислота.
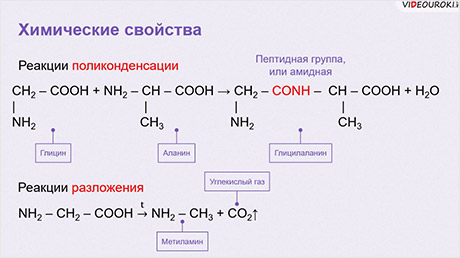
Для аминокислот характерны реакции поликонденсации с образованием полипептидов – белков. Так, при взаимодействии двух α-аминокислот образуется дипептид. Например, в реакции глицина и аланина образуется глицил-аланин, который является дипептидом. В результате взаимодействия образуется пептидная группа или амидная группа.
Для аминокислот характерны реакции разложения. Так, при разложении глицина образуются метиламин и углекислый газ.
Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам – продукт для получения капрона.
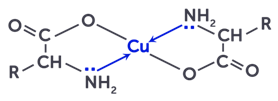
С ионами тяжёлых металлов α-аминокислоты образуют комплексные соли. Например, соли меди двухвалентной имеют голубую окраску и используются для обнаружения α-аминокислот.
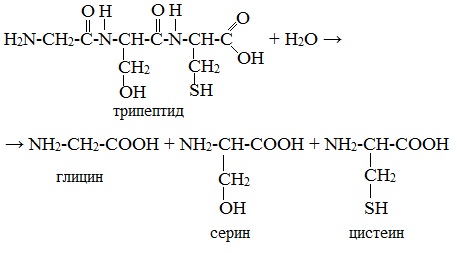
Большинство аминокислот являются биологически активными веществами. Так, трипептид глутатион является гормоном, который отвечает за детоксикацию чужеродных соединений в организме человека, а гормон окситоцин – нонапептид, вызывает сокращение мышц.
Таким образом, аминокислоты – это органические соединения, которые содержат карбоксильную группу с кислотными свойствами и аминогруппу с основными свойствами. Аминокислоты взаимодействуют как с кислотами, так и с основаниями, являясь амфотерными веществами. Аминокислоты реагируют друг с другом, образуя пептиды с различным числом остатков аминокислот. Аминокислоты и их производные имеют важное биологическое значение для жизнедеятельности человека.
Источник
Биотехнология получения аминокислот, витаминов, метаболитов
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
БИОТЕХНОЛОГИЯ ПОЛУЧЕНИЯ ПЕРВИЧНЫХ МЕТАБОЛИТОВ
3.1. Производство аминокислот
Среди соединений, получаемых биотехнологическими методами, аминокислоты занимают первое место по объему производства и второе место по стоимости, уступая по последнему параметру лишь антибиотикам. Объем мирового производства аминокислот составляет более 500 тыс. т в год, из которых 300 тыс. т приходится на глутамат натрия, 100 тыс. т на лизин и 140 тыс. т на метионин. Однако указанный объем — лишь небольшая доля от требуемого количества аминокислот. По данным ВОЗ, потребность человечества всего лишь в четырех незаменимых аминокислотах составляет, млн т: для лизина — 5, метионина — 4, треонина — 3,7 и триптофана — 2.
Аминокислоты — структурные единицы белков. Природные аминокислоты вовлечены в биосинтез ферментов, ряда гормонов, витаминов, антибиотиков, алкалоидов, токсинов и других азотсодержащих соединений (пурины, пиримидины, гем и пр.). В организме животного практически половина белковых аминокислот не синтезируется. Они называются незаменимыми аминокислотами и должны поступать в организм с пищей. Недостаток каждой из с этих аминокислот в пищевом или кормовом рационе приводит к нарушению обмена веществ, замедлению роста и развития. Сведения о ежедневной потребности человека в незаменимых аминокислотах представлены в табл. 3.2.
Таблица 3.3. Потребность ряда сельскохозяйственных животных в незаменимых аминокислотах ( % к сырому протеину)
| Аминокислота | Свиноматки | Куры-несушки | Коровы |
| Лизин | 5,0 | 5,0 | 4,5 |
| Метионин | 3,2 | 3,6 | 1,7 |
| Триптофан | 1,2 | 1,2 | — |
| Треонин | 6,0 | 4,0 | 3,4 |
Пищевая ценность белка определяется сравнением доли незаменимых аминокислот в пище с этим же показателем при адекватном питании. Чем ближе обе величины, тем выше качество белка. 5епки яйца и молока обладают высокой пищевой ценностью и используются в качестве эталона при оценке других белков. Многие белки растительного происхождения характеризуются дефицитом некоторых незаменимых аминокислот. Так, белки пшеницы и риса обеднены лизином и треонином, а белки кукурузы — пизином и триптофаном.
Введение синтетических незаменимых аминокислот в кормовые концентраты позволяет балансировать корма сельскохозяйственных животных по уровню белка. При добавлении 2 —4 дефицитных аминокислот к 1 т комбикорма общий расход кормов уменьшается на 15 — 20 %, выход продукции увеличивается на 20 %. Добавление к кормам аминокислот способствует переводу животноводства на промышленную основу. Данные о потребности некоторых сельскохозяйственных животных в незаменимых аминокислотах приведены в табл. 3.3.
Помимо применения в качестве пищевых добавок, приправ и усилителей вкуса аминокислоты используют как сырье в химической, парфюмерной и фармацевтической промышленности и при производстве ряда других веществ:
глицин — подсластитель, антиоксидант, бактериостатик;
аспарагиновая кислота — усилитель вкуса, сырье для синтеза асгтартама;
глутаминовая кислота — усилитель вкуса, препарат для лечения психических заболеваний;
гистидин — противовоспалительное средство;
метионин — пищевая и кормовая добавки;
цистеин — фармацевтический препарат;
треонин и триптофан — пищевые и кормовые добавки;
фенилаланин — сырье для получения аспартама;
лизин — пищевая и кормовая добавки, сырье для получения искусственных волокон и пленок.
В промышленных масштабах белковые аминокислоты получают:
- гидролизом природного белоксодержащего сырья;
- химическим синтезом;
- микробиологическим синтезом;
- биотрансформацией предшественников аминокислот с помощью микроорганизмов или выделенных из них ферментов (химико-микробиологический метод).
При гидролизе белоксодержащее сырье (отходы пищевой и молочной промышленности) нагревают с растворами кислот или щелочей при температуре 100 —105 °С в течение 20—48 ч. Чаще всего используют 20 %-й раствор соляной кислоты, обеспечивающий глубокий гидролиз белка. Кроме того, для ускорения реакции гидролиза белков используют иммобилизованные протеолитические ферменты и ионообменные смолы. В ходе кислотного гидролиза белков происходят рацемизация и разрушение некоторых составляющих их аминокислот. При кислотном гидролизе полностью разрушается триптофан и достаточно значительны потери цистеина, метионина и тирозина (10—30%). Лучшим способом уменьшения потерь аминокислот при гидролизе является проведение его в вакууме или в атмосфере инертного газа, а также соблюдение высокого соотношения количества кислоты, взятой для гидролиза, и массы белка (200:1). Рациональное использование сырья при гидролизе, характерное для многих других биотехнологических производств, обеспечивает создание безотходных технологий и способствует оздоровлению окружающей среды. Ранее методом гидролиза получали аминокислоты исключительно для фармацевтических и научных целей. В последнее время сфера использования белковых гидролизатов существенно расширилась. Их применяют в медицине, животноводстве, пищевой и микробиологической промышленности.
Существенный недостаток методов химического синтеза аминокислот состоит в получении целевых препаратов в виде рацемической смеси D- и L-стереоизомерных форм. Подавляющее большинство природных аминокислот относится к L-ряду. D-a-аминокислоты обнаружены лишь в составе гликопротеинов клеточных стенок бактерий, антибиотиков и некоторых токсинов. Проницаемость L-аминокислот в клетке в 500 раз превышает таковую ее антипода. Стереоспецифичны также транспорт и метаболизм аминокислот. Исключением в этом отношении является лишь метионин, метаболизм которого нестереоизбирателен, благодаря чему данная аминокислота получается преимущественно путем химического синтеза. Разделение рацематов других аминокислот — дорогая и чрезвычайно трудоемкая процедура.
Наиболее перспективен и экономически выгоден микробиологический синтез аминокислот. Более 60 % всех производимых в настоящее время промышленностью высокоочищенных препаратов белковых аминокислот получают именно этим способом, главное преимущество которого в сравнении с методами химического синтеза состоит в возможности получения L-аминокислот на основ возобновляемого сырья.
В последние годы при производстве аминокислот все шире используют биотрансформацию предшественников аминокислот, особенно с помощью иммобилизованных ферментов или клеток микроорганизмов, предварительно получаемых химическим путем.
Промышленное производство аминокислот стало возможным после открытия способности у некоторых микроорганизмов выделять в культуральную среду значительные количества какой-либо одной аминокислоты (С. Киносита, 1955). При этом было подмечено, что большинство из нескольких тысяч проанализированных диких штаммов микроорганизмов продуцировали аминокислоты во внешнюю среду, но в очень незначительных количествах. Не зафиксировано никакой связи между таксономическим положением микроорганизма и способностью к продуцированию той или иной аминокислоты. Так, среди возможных продуцентов глутаминовой кислоты отмечены организмы, из которых 30 % — дрожжи, 30% — стрептомицеты, 20% — бактерии и 10% — микроскопические грибы. И лишь один из обследованных штаммов микроорганизмов — Corynebacterium glutamicum был способен к сверхсинтезу глутамата. Этот штамм использовали при организации первого в мире крупномасштабного производства глутаминовой кислоты микробиологическим методом в Токио (1956). В России изыскания в области промышленного синтеза аминокислот были начаты в 50-х годах прошлого столетия по инициативе акад. А. А. Александрова.
Таблица 3.4 Микроорганизмы ― продуценты аминокислот (по Н. Б. Градовой и О. А. Решетник, 1987)
Перспективные штаммы продуцентов постоянно улучшают посредством селекции мутантов с измененной генетической программой и регуляторными свойствами. Распространенные объекты селекции продуцентов — микроорганизмы, относящиеся к родам Brevibacterium, Micrococcus, Corynebacterium, Arthrobacter (табл. 3.4).
Разработка технологической схемы получения отдельной аминокислоты полностью базируется на знании путей и механизмов регуляции биосинтеза конкретной аминокислоты. Необходимого дисбаланса метаболизма, обеспечивающего сверхсинтез целевого продукта, добиваются путем строго контролируемых изменений состава и условий среды.
Микробиологические методы производства аминокислот
Производство лизина. По содержанию лизина наименее сбалансированы белки злаковых культур, у которых его дефицит составляет от 20 до 50 %. На территории России недостаток лизина в кормах не может быть восполнен за счет сои, поэтому в нашей стране производство этой аминокислоты было организовано первым. Для удовлетворения потребностей животноводства в лизине крупнотоннажное производство налажено в Испании, Франции, Японии и США.
В клетках микроорганизмов лизин синтезируется из аспарагиновой кислоты и служит конечным продуктом разветвленного метаболического пути биосинтеза, общего для трех аминокислот — лизина, метионина и треонина (рис. 3.3).
Таким образом, в процессе новообразования аминокислот из общего предшественника одновременно с лизином возникают две другие аминокислоты — метионин и треонин. В этом случае эффекта накопления в среде всего одной целевой аминокислоты добиваются путем блокирования процессов, ведущих к синтезу побочных аминокислот, возникающих в связи с разветвлением метаболического пути.
Образование лизина в клетке бактерии находится под строгим метаболическим контролем. У типичных продуцентов L-лизина — Brevibacterium flavum и Corynebacterium glutamicum — фермент аспартаткиназа, открывающий метаболический путь, является аллостерическим белком, чувствительным к ингибированию по принципу обратной связи при совместном и согласованном действие побочных продуктов L-треонина и L-лизина. При накоплении треонина и лизина в избыточной концентрации ингибируется аспартаткиназа и их синтез останавливается, при пониженной концентрации любой из двух аминокислот процесс активизируется.
Чтобы добиться образования лизина в больших количества: получают мутанты двух типов. У мутантов первого типа не синтезруется или не функционирует гомосериндегидрогеназа, в результате чего блокируется синтез метионина и треонина. Такие мутанты являются ауксотрофами по гомосерину или треонину (метионину); внутриклеточная концентрация треонина у них существенно снижена, что снимает блокаду с аспартаткиназы. Поэтому при выращивании мутантных штаммов в среде, где присутствуют лимитирующие концентрации метионина и треонина, они способны образовывать избыточные количества лизина. Мутанты второго типа дефектны по структурному гену, детерминирующему конформацию аспартаткиназы. В итоге фермент теряет чувствительность к высоким концентрациям аллостерического ингибитора — лизина.
Важный фактор, обеспечивающий в культуральной среде высокие концентрации аминокислоты, синтезированной внутри клетки, — проницаемость клеточных мембран. Проницаемость клеточной мембраны увеличивают либо с помощью мутаций, либо путем изменения состава питательной среды. В последнем случае в культуральной среде создают дефицит биотина (1 — 5 мкл/л), добавляют пенициллин (2 — 4 мкг/л), детергенты (твин-40 и твин- 60) или производные высших жирных кислот (пальмитаты, стеараты). Биотин контролирует содержание в клеточной мембране фосфолипидов, а пенициллин нарушает биосинтез клеточных стенок бактерий, что повышает выделение аминокислот в среду.
Для культивирования штаммов микроорганизмов при производстве аминокислот как источники углерода наиболее доступны углеводы — глюкоза, сахароза и реже фруктоза и мальтоза. Для снижения стоимости питательной среды в качестве источников углерода используют вторичное сырье: свекловичную мелассу, молочную сыворотку, гидролизаты крахмала, сульфитные щелока. Технология этого процесса совершенствуется в направлении разработки дешевых синтетических питательных сред на основе уксусной кислоты (до 1,5%), пропионовой кислоты, метанола, этанола (до 1 %) и н-парафинов. В качестве источников азота применяют мочевину и соли аммония (сульфаты и фосфаты).
Для успешного развития микроорганизмы нуждаются в стимуляторах роста, в качестве которых выступают экстракты кукурузы, дрожжей и солодовых ростков, гидролизаты отрубей и дрожжей, витамины группы В. Кроме того, в питательную среду добавляют необходимые для жизнедеятельности макро- и микроэлементы (Р, Са, Mg, Мп, Feи др.). На процесс биосинтеза аминокислот существенное влияние оказывает снабжение воздухом, при этом степень аэрации индивидуальна для производства каждой конкретной аминокислоты. Стерильный воздух подается специальными турбинными мешалками (рис. 3.4). Опыты показали, что лизин появляется в культуральной среде начиная с середины экспоненциальной фазы роста культуры клеток микроорганизма и достигает максимума к ее концу. Поэтому на первой стадии технологического процесса формируют биомассу продуцента, которую выращивают в специальных посевных аппаратах в течение суток (рН 7,0 — 7,2; температура 28 — 30 °С), а затем подают в производственный ферментер, заполненный питательной средой. Лизин начинает поступать в культуральную жидкость через 25 — 30 ч после начала ферментации. По завершении процесса ферментации (через 55 — 72 ч) жидкую фазу отделяют от культуры клеток микроорганизма фильтрованием и используют для выделения из нее лизина.
Высокоочищенные препараты лизина получают после фракционирования фильтрата культуральной жидкости методом ионообменной хроматографии на катеоните. С этой целью лизин переводят в форму катиона:
Для данного процесса фильтрат обрабатывают соляной кислотой до рН 1,6—2,0 (рН
Источник