Алкены
Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2. Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия алкенов
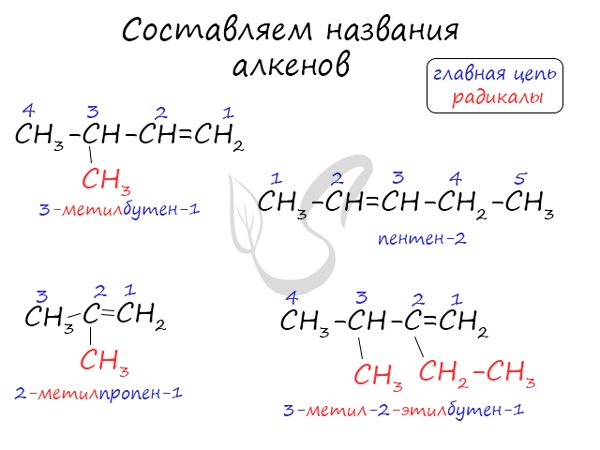
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
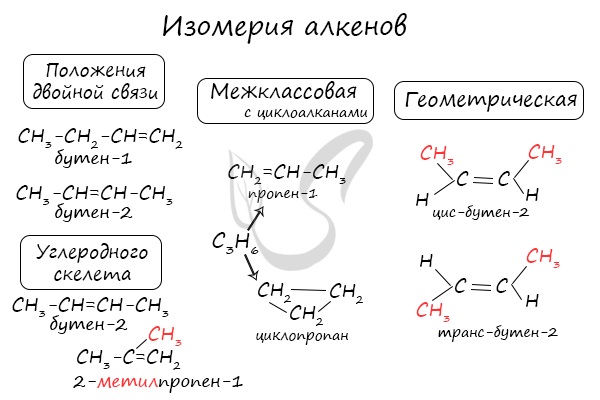
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp 2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
В результате крекинга нефти образуется один алкан и один алкен.
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный.
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.
В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.
При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
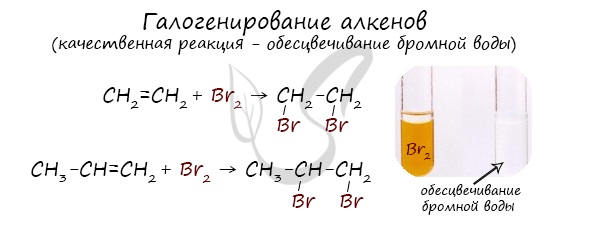
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.
Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа — к наименее гидрированному.
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном окислении образуются окиси.
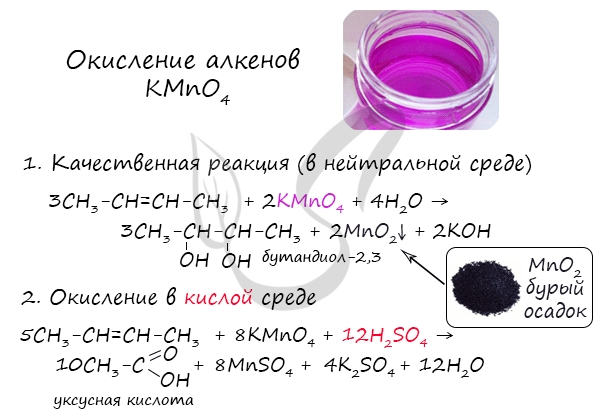
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2.
В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной связи.
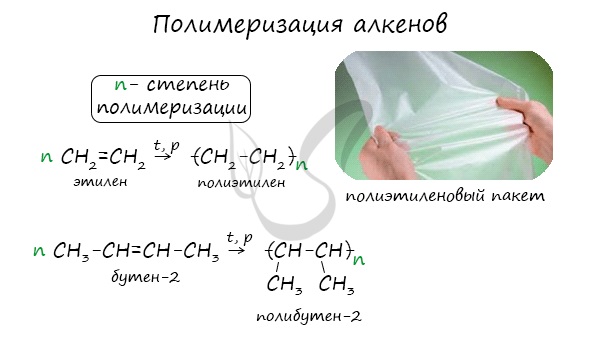
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Разработка урока химии «Алкины. Изомеры и гомологи. Номенклатура. Физические и химические свойства алкинов»
Муниципальное бюджетное общеобразовательное учреждение
«Гвардейская школа № 1» Симферопольского района Республики Крым
ул. Карла Маркса, дом 97, пгт Гвардейское, Симферопольский район,
Республика Крым, Российская Федерация, 297513
тел. (3652) 32-30-45, e-mail: gvardeiskay1@mail.ru ОГРН 1159102031329, ИНН 9109010395
« Алкины. Электронное и пространственное строение ацетилена. Гомологи и изомеры. Номенклатура. Физические и химические свойства. Реакции присоединения и замещения. Получение. Применение »
(разработка урока химии)
Учитель химии высшей категории
Стулень Виктор Иванович
пгт Гвардейское, 2020 год
10 класс. Урок № 15.
Тема. Алкины. Электронное и пространственное строение ацетилена. Гомологи и изомеры. Номенклатура. Физические и химические свойства. Реакции присоединения и замещения. Получение. Применение.
Цели урока: сформировать представление обучающихся о гомологическом ряде алкинов, правилах номенклатуры алкинов;
— формировать умение называть вещества по формулам и составлять структурные формулы веществ по их названиям;
— изучить физические и химические свойства алкинов на примере ацетилена.
Планируемые результаты обучения:
— Уметь применять правила международной номенклатуры ИЮПАК как средства идентификации веществ по их составу и строению;
— уметь составлять молекулярные и структурные формулы;
— уметь приводить примеры химических реакций, раскрывающих характерные свойства типичных представителей алкинов с объяснения области их применения.
— приучать детей к доброжелательному общению, умению слушать аргументацию других, взаимопомощи, самопроверке, самооценке;
— развивать монологическую речь с использованием химических терминов.
— Ориентация обучающихся на реализацию позитивных жизненных перспектив, инициативность, креативность, способность к личностному самоопределению, способность ставить цели и строить жизненные планы;
— готовность обучающихся к отстаиванию собственного мнения;
— готовность и способность обучающихся к саморазвитию и самовоспитанию в соответствии с общечеловеческими ценностями и идеалами гражданского общества.
Демонстрация 8. Получение ацетилена карбидным способом.
Демонстрация 9. Взаимодействие ацетилена с раствором перманганата калия и бромной водой.
Демонстрация 10. Горение ацетилена.
Оборудование: набор оборудования и реактивов для выполнения демонстрационных опытов, мультимедиа доска, карточки с вопросами и заданиями, таблица «Метан. Этилен. Ацетилен», таблица «Строение молекулы ацетилена», таблица «Применение ацетилена», презентация «Выдающийся русский химик М.Г. Кучеров», учебник «Химия. 10 класс: базовый уровень/ Рудзитис Г.Е., Фельдман Ф.Г. Москва, Просвещение, 2014 г.».
Тип урока: комбинированный урок.
1. Организация класса к уроку.
Проверяю готовность класса к уроку, отмечаю отсутствующих, записываем число и «Классная работа».
2. Актуализация опорных знаний обучающихся. Подготовка к усвоению нового материала.
2.1. Объявление отметок за практическую работу №2 «Получение этилена и изучение его свойств».
— Ребята. На предыдущем уроке вы писали практическую работу.
Объявление отметок и краткий анализ выполнения заданий практической работы №2 «Получение этилена и изучение его свойств».
2.2. На рабочих местах фронтальная беседа по вопросам (вопросы распечатаны на каждую парту, приложение 1).
1. Какая углерод-углеродная связь характерна для алканов?
2. Какая углерод-углеродная связь характерна для алкенов?
3. Какие связи существуют между атомами углерода, какие связи называют кратными?
4. Объясните содержание понятия «номенклатура».
5. Что означают понятия «гомологи», «гомологический ряд»?
6. Какие вещества попадают под определение «изомеры»?
2.3. Самостоятельная работа на рабочих местах, решение задач (текст распечатан на каждую парту, приложение 2).
Углеводород содержит 88,89% углерода и 11,11% водорода, относительная плотность вещества по кислороду 1,6875. Найдите молекулярную формулу углеводорода, запишите полную структурную формулу его.
Углеводород содержит 7,69% водорода и 92,31% углерода, относительная плотность вещества по азоту равна 0,9286. Найдите молекулярную формулу углеводорода, запишите полную структурную формулу его.
Контрольные данные для проверки правильности решения задач :
1 вариант. Простейшая формула С2Н3, М(в-ва) = 54 г/моль, n = 2, формула вещества С4Н6.
2 вариант. Простейшая формула СН, М(в-ва) = 26 г/моль, n = 2, формула вещества С2Н2.
3. Формулирование темы урока при участии обучающихся.
Запишите сокращённую структурную формулу каждого из веществ на доске.
1 вариант. Брутто-формула вещества С4Н6, структурная формула
2 вариант. Брутто-формула вещества С2Н2, структурная формула H—C≡C—H
— Чем отличаются эти структурные формулы от формул изученных углеводородов ?
— Правильно, наличие тройной связи свидетельствует о том, что вещества этого класса мы ещё на изучали.
— Попробуйте сформулировать тему нынешнего урока.
Обучающиеся формулируют возможную тему урока.
— Запишите тему урока (тема демонстрируется на мультимедиа доске): Алкины. Электронное и пространственное строение ацетилена. Гомологи и изомеры. Номенклатура. Физические и химические свойства. Реакции присоединения и замещения. Получение. Применение.
4. Формулирование целей и задач урока при помощи обучающихся. Мотивация учебной деятельности.
Возможные цели и задачи урока:
— сформировать представление о гомологическом ряде алкинов, правилах номенклатуры;
— уметь записывать формулы изомеров и гомологов для данного вещества, уметь называть вещества по их формулам и составлять структурные формулы веществ по их названиям;
— изучить физические и химические свойства алкинов;
— совершенствовать представления о классификации и общих закономерностях течения химических реакций;
— знать способы получения и области применения алкинов на примере ацетилена;
— формировать навыки коллективной и групповой (парной) работы в сочетании с самостоятельностью обучающихся;
— приучаться к доброжелательному общению, умению слушать других, взаимопомощи, взаимопроверке, самооценке;
— воспитывать уверенность в своих силах при работе с учебным материалом.
5. Изучение нового материала.
5.1. Алкины. Гомологический ряд алкинов.
— Запишите определение «Алкины» из учебника (стр. 60):
Алкины (ацетиленовые углеводороды) — это углеводороды с общей
— Простейший представитель алкинов — этин (ацетилен) С2Н2, или H—C≡C—H.
— Гомологический ряд алкинов (брутто-формулы записываются в столбик, соблюдается гомологическая разность атомов СН2): C2H2 — этин; C3H4 — пропин; C4H6 — бутин; C5H8 — пентин; C6H10 — гексин и т.д.
5.2. Номенклатура алкинов.
— Запишите в справочном отделе в конце тетради принципы номенклатуры алкинов (текст распечатан на каждую парту, приложение 3) :
10. Атомы углерода, связанные тройной связью, должны обязательно входить в главную цепь. Нумерацию атомов углерода начинаем от того края молекулы, к которому ближе тройная связь.
11. Наличие тройной связи в формуле указываем суффиксом «-ин» и цифрой.
5.3. Изомерия алкинов.
Для алкинов характерны такие виды изомерии (запись формул на доске учителем, либо учащимся):
1) изомерия углеродного скелета (пентин-1, 3-метилбутин-1);
2) изомерия положения кратной связи (бутин-1, бутин-2);
3) межклассовая изомерия (бутин-1, бутадиен-1,3, циклобутен-1, 1-метилциклопропен).
* один учащийся у доски, остальные — на месте выполняют задание:
Для вещества состава C5H8 составьте формулы всех возможных изомеров и назовите вещества.
5.4. Электронное и пространственное строение молекулы ацетилена.
— Атомы углерода в органических соединениях находятся в возбуждённом состоянии, поэтому содержат на внешнем энергетическом уровне 4 неспаренных валентных электрона.
— Один из них образует сигма-связь с атомом водорода, оставшиеся три неспаренные электрона каждого из атомов углерода образуют три общие электронные пары — три связи (одну — сигма-связь и две пи-связи) между собой.
— Молекула ацетилена имеет линейное строение Н:С. С:Н, валентный угол 180 градусов.
По таблице «Строение молекулы ацетилена» рассматривается sp-гибридизация атомов углерода у тройной связи, пространственное строение молекулы ацетилена.
5.5. Физические свойства алкинов (текст распечатан на каждую парту, приложение 4) :
Агрегатное состояние алкинов:
C 17 H 32 и более – твёрдые вещества (парафины).
Незначительно растворимы в воде только низшие представители алкинов.
При нормальных условиях ацетилен – бесцветный газ, легче воздуха; молярная масса ацетилена 26 г/моль, средняя молярная масса воздуха 29 г/моль. Чистый газ (100 %) на имеет запаха, резкий запах придают примеси. Малорастворим в воде (в 1 литре воды растворяется около 1 литра ацетилена C2H2), хорошо растворяется в ацетоне. Температура плавления -83,6 °C, температура к ипения -80,8 °C.
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагревании до 500 °C или при давлении выше 0,2 МПа (2 атмосферы) при комнатной температуре.
Струя ацетилена, выпущенная в открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки.
Для хранения технического ацетилена используют специальные баллоны, заполненные пористым материалом, пропитанным ацетоном.
Ф И З К У Л Ь Т М И Н У Т К А
5.6. Получение ацетилена.
— Запишите способы получения ацетилена 1) в лаборатории и 2) в промышленности — из учебника (с.61, с.62):
1) в лаборатории ацетилен получают гидролизом (взаимодействие с водой) карбида кальция:
карбид вода гидроксид этин,
кальция кальция ацетилен
2) в промышленности ацетилен получают при термическом разложении метана:
метан этин, водород
Для этого поток метана в реакционной башне нагревают до 1600 °C, а затем резко охлаждают до 80 °C, разложение метана останавливается на стадии получения ацетилена.
*3) Д ля получения ацетилена используют также реакции дегидрирования (отщепления водорода) алканов (предельных углеводородов) и алкенов (непредельных этиленовых у/в):
этан этин водород
этен этин водород
Реакции проводят при температурах 1100 – 1200 °C и пониженном давлении.
*4) Ацетилен можно получать крекингом метана в вольтовой дуге ( t = 1600 °C):
метан этин водород
5.7. Химические свойства ацетилена. Реакции присоединения и замещения.
План изучения химических свойств ацетилена (текст распечатан на каждую парту, приложение 5) :
1. Реакции окисления.
1.1. Окисление кислородом воздуха (горение на воздухе) (стр. 63).
1.2. Окисление водным раствором перманганата калия (стр. 63).
2. Реакции присоединения.
2.1. Гидрирование (присоединение водорода H 2 ) (стр. 62).
2.2. Гидрогалогенирование (присоединение галогеноводорода HCl или HBr ) (стр. 63).
2.3. Галогенирование (присоединение галогена Cl 2 или Br 2 ) (стр. 62).
2.4. Гидратация (присоединение воды H 2 O ) (стр. 62).
*3. Реакции замещения.
3.1. Взаимодействие с металлическим натрием (найти дома).
3.2. Взаимодействие с комплексной солью меди ( I ) и комплексной солью серебра (найти дома).
4. Реакции полимеризации.
4.1. Димеризация в присутствии водного раствора хлорида меди ( I ) (найти дома).
4.2. Тримеризация при нагревании над активированным углём, получение бензола (стр. 69).
— А сейчас рассмотрим один из способов получения ацетилена и некоторые его свойства. Полученный ацетилен я поочерёдно пропускаю в пробирки с водным раствором перманганата калия и бромной водой. Затем наблюдаем горение ацетилена на воздухе.
Демонстрация 8. Получение ацетилена карбидным способом.
Демонстрация 9. Взаимодействие ацетилена с раствором перманганата калия и бромной водой.
Демонстрация 10. Горение ацетилена.
— Запишите химические свойства ацетилена согласно плану.
1. Реакции окисления.
1.1. Окисление кислородом воздуха (горение на воздухе) (стр. 63).
На воздухе ацетилен горит коптящим красноватым пламенем. Если при горении в пламя дополнительно вдувать воздух, то ацетилен сгорает полностью белым ярким пламенем.
2СH≡CH + 5О 2 → 4CО 2 + 2H 2 О + 2511,2 кДж
Температура ацетиленово-кислородного пламени достигает 2800 — 3000 °С. На этом основано применение ацетилена для сварки и резки металлов (автоген). Смеси ацетилена с воздухом или кислородом в любых соотношениях взрывоопасны.
1.2. Окисление водным раствором перманганата калия (стр. 63).
Ацетилен легко окисляется окислителями КMnO4, K2Cr2O7. Алкины обесцвечивают даже разбавленный раствор перманганата калия, что доказывает их ненасыщенность.
а) мягкое окисление. Мягкое окисление алкинов происходит без разрыва σ-связи С─С (разрушаются только π-связи).
При взаимодействии ацетилена с разбавленным раствором КMnO4 при комнатной температуре образуется двухосновная щавелевая кислота:
б) жесткое окисление. При значительном нагревании реагентов или в присутствии концентрированной серной кислоты происходит полное окисление ацетилена до оксида углерода ( IV ) (углекислого газа):
3С H ≡ CH + 10 KMnO 4 + 2 H 2 О = 6 C О 2 + 10 KOH + 10 MnO 2
Реакция с КMnO4 является качественной реакцией на алкины. Раствор перманганата калия обесцвечивается.
2. Реакции присоединения.
Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что π- электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
2.1. Гидрирование (присоединение водорода H 2 ) (стр. 62).
Присоединение водорода происходит при нагревании в присутствии металлических катализаторов. Реакция протекает в две стадии: сначала алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем образованием алканов (разрывается вторая π-связь):

2.2. Гидрогалогенирование (присоединение галогеноводорода HCl или HBr ) (стр. 63).
Галогеноводороды присоединяются к алкинам в две стадии. Причём, вторая стадия идёт по правилу Марковникова:

Получаемый по первой стадии продукт хлорэтен (винилхлорид) – подобно этилену легко полимеризуется, образуя поливинилхлорид (полихлорвинил, ПВХ, ПХВ), который широко применяется в производстве поливинилхлоридных смол:

Присоединение галогенов протекает также в две стадии. На первой стадии образуются дигалогеналкены, на второй – тетрагалогеналканы:
СH≡CH + Br 2 → CHBr=CHBr
Бромная вода обесцвечивается. Реакция является качественной реакцией на алкины.
2.4. Гидратация (присоединение воды H 2 O , реакция М.Г. Кучерова, 1881 год) (стр. 62).
Демонстрирую презентацию «Выдающийся русский химик М ихаил Г ригорьевич Кучеров».
Присоединение воды протекает в присутствии солей ртути (II) при нагревании — HgSO4, Hg(NO3)2 с образованием этаналя (уксусного альдегида) (при обычных условиях ацетилен с водой не взаимодействует):

Отличительной чертой спиртовой гидроксогруппы около атома углерода с двойной связью является её значительная неустойчивость. В момент образования она самопроизвольно изомеризуется в более стабильное карбонильное соединение – альдегид.
*3. Реакции замещения.
Особенностью алкинов, имеющих концевую тройную связь (алкины-1), является их способность проявлять слабые кислотные свойства.
Атомы водорода, связанные с sp-гибридизованными атомами углерода в молекулах алкинов, обладают значительной подвижностью, что объясняется значительной поляризацией σ-связи ≡С─Н. Поэтому атомы водорода могут замещаться атомами металлов, в результате чего образуются соли – ацетилениды.
*3.1. Взаимодействие с металлическим натрием (найти дома).
Реакция происходит при нагревании до 150 °C раствора натрия в аммиаке

Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена.
*3.2. Взаимодействие с комплексной солью меди ( I ) и комплексной солью серебра (найти дома).
Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I):

Образование серовато-белого осадка ацетиленида серебра или красно-коричневого ацетиленида меди (I) служит качественной реакцией на концевую тройную связь.
Ацетилениды серебра и меди (I) в сухом виде взрываются от удара. Однако, карбид кальция, который также является ацетиленидом, очень устойчив к удару. Он массово используется для получения ацетилена в лаборатории и для газосварки и газорезки металлов.
4. Реакции полимеризации.
В присутствии катализаторов алкины способны реагировать друг с другом, при этом в зависимости от условий образуются различные продукты.
4.1. Димеризация в присутствии водного раствора хлорида меди ( I ) (найти дома).
Димеризация ацетилена происходит под действием водно-аммиачного раствора хлорида меди ( I ):

4.2. Тримеризация при нагревании над активированным углём, получение бензола (реакция Н.Д. Зелинского, 1927 год) (стр. 69).
Тримеризация ацетилена при нагревании над активированным углём приводит к образованию бензола:


5.8. Применение ацетилена (стр. 64) (найти дома).
Области применения ацетилена тесно связаны с проявляемыми им свойствами.
1) для газовой высокотемпературной сварки и резки металлов (автоген);
2) как источник очень яркого, белого света в автономных светильниках, в которых он получается реакцией карбида кальция и воды (карбидная лампа);
3) в производстве взрывчатых веществ, капсюлей патронов и снарядов (ацетилениды металлов, в частности, серебра);
4) для получения этилового спирта, уксусной кислоты, растворителей (дихлорэтан, трихлорэтан, тетрахлорэтан), пластмасс, каучука, ароматических углеводородов;
5) для получения технического углерода (чистой сажи);
6) в ракетных двигателях как компонент ракетного топлива (вместе с аммиаком).
6. Первичное закрепление изученного материала.
6.1. Запишите уравнения химических реакций присоединения для пропина-1, назовите вещества.
7. Закрепление, обсуждение и коррекция изученного материала.
Один обучающийся из числа работавших на месте записывает на доске ответы задания с комментированием ответов.
Обсуждение правильности выполнения заданий эстафеты, поиск ошибок и причин допущенных ошибок.
8. Подведение итогов занятия.
Подводится итог-обобщение изученного на уроке материала.
Объявление оценок, полученных обучающимися за урок.
9. Задаётся и объясняется домашнее задание.
— Ребята! Запишите, пожалуйста, домашнее задание к следующему уроку (задание появляется на мультимедиа доске или записано на обороте обычной доски):
Учить §14 (с. 60-65) (учить номенклатуру и виды изомерии алкинов; способы получения, химические свойства и области применения ацетилена), упражнение 5а, б (с.65) выполнить.
— До свидания, ребята! Спасибо за хорошую работу на уроке.
Источник