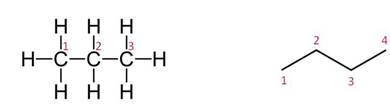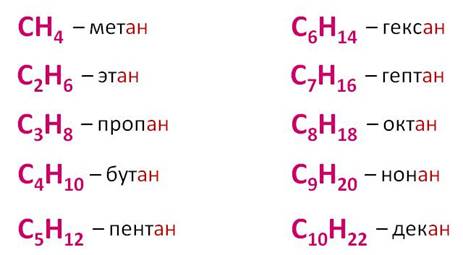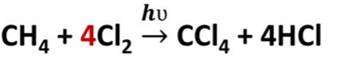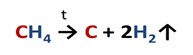Алканы общая формула строение способы получения
I. АЛКАНЫ (предельные углеводороды, парафины)
Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи.
Алканы – название предельных углеводородов по международной номенклатуре.
Парафины– исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – имеющий мало сродства, малоактивный).
Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода.
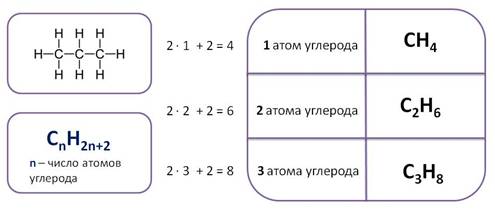
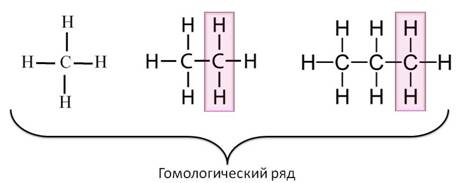
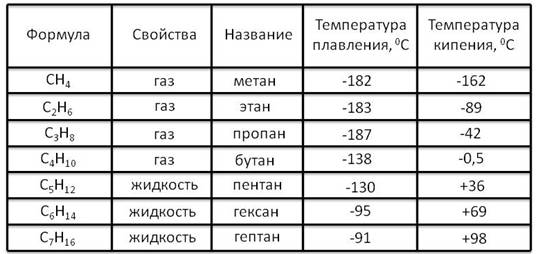
Простейшие представители алканов:

При сравнении этих соединений видно, что они отличаются друг от друга на группу -СН2— (метилен). Добавляя к пропану еще одну группу -СН2— , получим бутан С4Н10 , затем алканы С5Н12 , С6Н14 и т.д.
Теперь можно вывести общую формулу алканов. Число атомов углерода в ряду алканов примем за n, тогда число атомов водорода составит величину 2n+2. Следовательно, состав алканов соответствует общей формуле CnH2n+2.
Поэтому часто используется такое определение:
- Алканы — углеводороды, состав которых выражается общей формулой CnH2n+2, где n – число атомов углерода.
Химическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их структурные формулы. Из этих формул видно, что в алканах имеются два типа химических связей:
Связь С–С является ковалентной неполярной. Связь С–Н — ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности (2.5 — для углерода и 2.1 — для водорода). Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью электронных формул:
Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое существенно влияет на свойства вещества.
Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности.
Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации. Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp 3 -гибридизации. В этом случае каждая из четырех sp 3 -гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp 3 -АО другого атома углерода, образуя σ-связи С-Н или С-С.
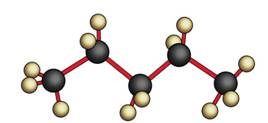
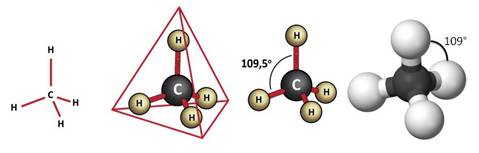
Четыре σ-связи углерода направлены в пространстве под углом 109 о 28′, что соответствует наименьшему отталкиванию электронов. Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода:
 |  |
Для записи удобно использовать пространственную (стереохимическую) формулу.
В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp 3 -атома углерода образуют более сложную пространственную конструкцию:
III. Изомерия алканов .
Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами .
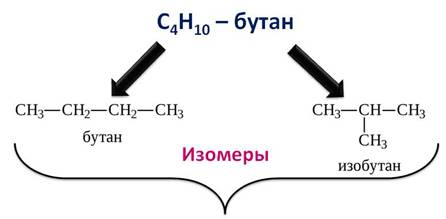
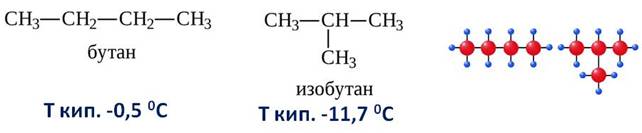
1. Различия в порядке соединения атомов в молекулах (т.е. в химическом строении) приводят к структурной изомерии. Строение структурных изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т.е. начиная с бутана С4Н10.
Структурные изомеры — соединения одинакового состава, отличающиеся порядком связывания атомов, т.е. химическим строением молекул.
Причиной проявления структурной изомерии в ряду алканов являетсяспособность атомов углерода образовывать цепи различного строения.Этот вид структурной изомерии называется изомерией углеродного скелета.
Например, алкан состава C4H10 может существовать в виде двух структурных изомеров:
а алкан С 5 Н 12 – в виде трех структурных изомеров,отличающихся строением углеродной цепи:
При выводе структурных формул изомеров используют следующие приемы.
2. Если в молекулах одинакового состава и одинакового химического строения возможно различное взаимное расположение атомов в пространстве, то наблюдается пространственная изомерия (стереоизомерия). В этом случае использование структурных формул недостаточно и следует применять модели молекул или специальные формулы — стереохимические (пространственные) или проекционные.
Алканы, начиная с этана H3C–СН3, существуют в различных пространственных формах (конформациях), обусловленных внутримолекулярным вращением по σ-связям С–С, и проявляют так называемую поворотную (конформационную) изомерию.
Различные пространственные формы молекулы, переходящие друг в друга путем вращения вокруг σ-связей С–С, называют конформациями или поворотными изомерами (конформерами).
Поворотные изомеры молекулы представляют собой энергетически неравноценные ее состояния. Их взаимопревращение происходит быстро и постоянно в результате теплового движения. Поэтому поворотные изомеры не удается выделить в индивидуальном виде, но их существование доказано физическими методами. Некоторые конформации более устойчивы (энергетически выгодны) и молекула пребывает в таких состояниях более длительное время.
3. Кроме того, при наличии в молекуле атома углерода, связанного с 4-мя различными заместителями, возможен еще один вид пространственной изомерии — оптическая изомерия .
то возможно существование двух соединений с одинаковой структурной формулой, но отличающихся пространственным строением. Молекулы таких соединений относятся друг к другу как предмет и его зеркальное изображение и являются пространственными изомерами.
Изомерия этого вида называется оптической, изомеры – оптическими изомерами или оптическими антиподами:

Молекулы оптических изомеров несовместимы в пространстве (как левая и правая руки), в них отсутствует плоскость симметрии.
Таким образом,
оптическими изомерами называются пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптические изомеры имеют одинаковые физические и химические свойства, но различаются отношением к поляризованному свету. Такие изомеры обладают оптической активностью (один из них вращает плоскость поляризованного света влево, а другой — на такой же угол вправо). Различия в химических свойствах наблюдаются только в реакциях с оптически активными реагентами.
Оптическая изомерия проявляется в органических веществах различных классов и играет очень важную роль в химии природных соединений.
Источник
Способы получения алканов
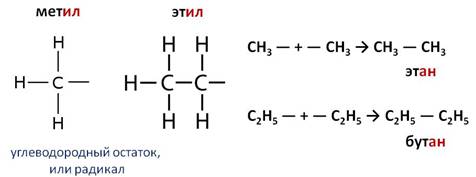
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
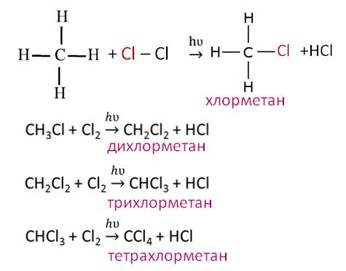
| Например, хлорметан реагирует с натрием с образованием этана:
Хлорэтан взаимодействует с натрием с образованием бутана: Реакция больше подходит для получения симметричных алканов. При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
|