- 5 способов применения альдегиды
- Альдегиды и кетоны
- Строение карбонильных соединений
- Номенклатура карбонильных соединений
- Изомерия карбонильных соединений
- Изомерия альдегидов
- Изомерия кетонов
- Физические свойства альдегидов и кетонов
- Химические свойства альдегидов и кетонов
- 1.1. Гидрирование
- 1.2. Присоединение воды
- 1.3. Присоединение спиртов
- 1.4. Присоединение циановодородной (синильной) кислоты
- 2. Окисление альдегидов и кетонов
- 2.1. Окисление гидроксидом меди (II)
- 2.2. Окисление аммиачным раствором оксида серебра
- 2.3. Жесткое окисление
- 2.4. Горение карбонильных соединений
- 3. Замещение водорода у атома углерода, соседнего с карбонильной группой
- 4. Конденсация с фенолами
- 5. Полимеризация альдегидов
- Получение карбонильных соединений
- 1. Окисление спиртов
- 1.1. Окисление спиртов оксидом меди (II)
- 1.2. Окисление спиртов кислородом на меди
- 1.3. Окисление спиртов сильными окислителями
- 2. Дегидрирование спиртов
- 3. Гидратация алкинов
- 4. Гидролиз дигалогенпроизводных алканов
- 5. Пиролиз солей карбоновых кислот
- 6. Кумольный способ получения ацетона
- 7. Каталитическое окисление алкенов
5 способов применения альдегиды
Из карбонильных соединений наибольшее применение находят формальдегид, ацетальдегид и ацетон.
Формальдегид (метаналь, муравьиный альдегид) Н-СНО широко используется для получения фенолформальдегидных и мочевино-формальдегидных (карбамидных) смол, пластмасс, для синтеза лекарственных средств (уротропин), продуктов органического синтеза, как дезинфицирующее средство и консервант биологических и анатомических препаратов, в кожевенном производстве – для обработки кож.
40% водный раствор формальдегида называют формалином. Его использование основано на свойстве свертывать белок. Действуя на белок, формалин делает его плотным, нерастворимым в воде и, главное, предохраняет от гниения. Поэтому его применяют для консервирования анатомических препаратов. Формалин прекрасно сохраняет костный материал, необходимый для восстановления живых тканей, проведения пластических операций.
В кожевном производстве дубящее действие формалина также основано на способности свертывать белок, в результате чего кожа твердеет и не подвергается гниению.
Вследствие высокой токсичности, обусловленной способностью формальдегида свертывать белки, он может использоваться лишь в качестве средства для дезинфекции помещений, хирургических инструментов.
Формалин применяется в сельском хозяйстве для дезинфекции зерно- и овощехранилищ, парников и теплиц, для протравливания семян с целью уничтожения личинок вредителей.
Большое количество метаналя используют для получения фенолформальдегидной смолы при его взаимодействии с фенолом. Эта смола необходима для производства различных пластмасс. Пластмассы, изготовленные из фенолформальдегидной смолы в сочетании с рзличными наполнителями, называют фенопластами.
На основе фенолформальдегидных смол готовят клеи, лаки, эмали, краски, политуры. Из полиформальдегида изготавливают литые и пленочные изделия.
Древесно-стружечные плиты (ДСП) изготавливают из древесных опилок и фенолформальдегидных смол. Мебель, изготовленная из таких плит, выделяет формальдегид и поэтому представляет опасность для здоровья. Помещение, где находится такая мебель, следует часто проветривать.
При взаимодействии формальдегида с карбамидом СО(NH2)2 получают карбамидную смолу, а из нее – аминопласты. Из этих пластмасс изготавливают микропористые материалы для нужд электротехники (выключатели, розетки и др.).
Немецкий химик А. Байер в 1872 г. из фенола и формальдегида получил смолообразный продукт. Бельгийский ученый Л. Бакеланд разработал способ получения этого вещества в промышленности. Так, с 1912 г. производится фенолформальедгидная смола, названная бакелитом.
А.М. Бутлеров в 1860 г. впервые синтезировал из формальдегида и аммиака органическое вещество гексаметилентетрамин, или утротропин, которое используется в медицине.
Взаимодействием формальдегида с аммиаком получают уротропин – лекарственный препарат (используют в качестве мочегонного средства, при лечении почечных заболеваний).

Уротропин применяют также в качестве ингибитора кислотной коррозии металлов и в производстве взрывчатых веществ.
Нитрование уротропина приводит к образованию сильного взрывчатого вещества «гексоген»:
Ацетальдегид (уксусный альдегид, этаналь) СН3-СНО находит широкое применение в промышленном органическом синтезе. Он служит сырьем для получения уксусной кислоты, уксусного ангидрида, этилацетата, хлораля, этилового и бутилового спиртов, синтетических смол и ряда других соединений.
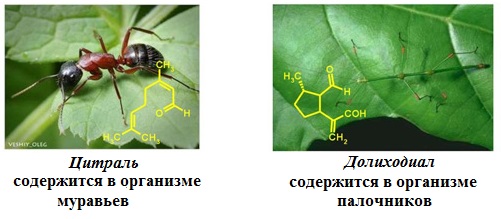
Высшие непредельные и ароматические альдегиды и кетоны входят в состав эфирных масел и содержатся во многих цветах, фруктах, плодах, душистых и пряных растениях. Из-за приятного запаха они широко применяются в парфюмерии.
Ароматический кетон бензофенон (дифенилкетон) (С6Н5)2С=О с запахом герани, используется в парфюмерных композициях и для ароматизации мыла. Бензофенон и его производные способны поглощать УФ-лучи, что определило их применение в кремах и лосьонах от загара. Кроме того, некоторые производные бензофенона обладают противомикробной активностью и применяются в качестве консервантов.
Алифатический пеларгоновый альдегид (нониловый альдегид) СН3(СН2)7СНО содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор.
Ванилин C8H8O3 как душистое вещество используют в пищевой и парфюмерной промышленности. Но в последнее время чаще используется синтетический ванилин — широко известная ароматизирующая добавка в кондитерские изделия. Ванилин является исходным веществом в синтезе противотуберкулезного препарата «Фтивазида».
Коричный альдегид С6Н5СН=СНСНО применяется в кулинарии в виде палочек или порошка.
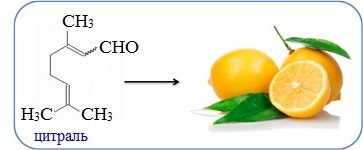
Цитраль C10H16O имеет интенсивный лимонный запах и является важнейшим компонентом композиций и отдушек средств бытовой химии, косметических и парфюмерных веществ.
Многие насекомые при нападении врагов используют средства химической защиты – выделяют соединения, которые обладают сильным, летучим запахом. Эти соединения оказывают раздражающее действие, а капли попавшие на покровы хищника могут вызвать раздражение и зуд.
Гидрооксицитронеллаль (7-гидрокси-3,7-диметил-октаналъ) (СН3)2С(ОН)(СН2)3СН(СН)зСН2СНО – густая бесцветная жидкость со свежим запахом липы, с нотой ландыша. Его используют для приготовления многих композиций и отдушек.
Бензальдегид С6Н5СН=О обладает запахом горького миндаля. Бензальдегид содержится в эфирных маслах, а в виде гликозида амигдалина – в семенах горького миндаля, косточек вишни, абрикоса, персика.
Он применяется в качестве компонента парфюмерных композиций и пищевых эссенций как сырье для синтеза душистых веществ – коричного альдегида, коричной кислоты, бензилбензоата, трифенилметановых красителей.
Акролеин (пропеналь) СН2=СН-СНО является исходным сырьем для синтеза многих органических соединений. Его применяют для получения пластмасс, отличающихся большой твердостью, акрилонитрила, глицерина, аллилового спирта, акриловой кислоты, лекарственных средств.
Кротоновый альдегид CH3CH=CHCHO – сильный лакриматор, используется для получения бутанола, сорбиновой и масляной кислот. Содержится в соевом масле.
Фенилэтаналь (фенилуксусный альдегид) C6H5CH2CHO имеет запах гиацинта. Добавление незначительного количества его к парфюмерным композициям придает им приятный цветочный оттенок.

Ацетофенон (метилфенилкетон) C6H5COCH3 используют как душистое вещество в парфюмерии, а также в синтезе некоторых лекарственных препаратов.
Диацетил (2,3-бутандион, диметилглиоксаль) С4H6O2 – имеет запах свежих сливок, используется как пищевая добавка для придания продуктам запаха масла или сыра.
Циклогексанон С6Н10О применяется в синтезе капролактама – мономера в производстве поликапроамида (капрон, дедерон, нейлон-6 и др.
Источник
Альдегиды и кетоны
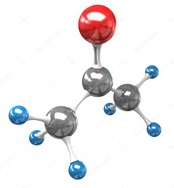
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
| Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. |
Структурная формула альдегидов:
| Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами . |
Структурная формула кетонов:
Строение карбонильных соединений
Атом углерода в карбонильной группе находится в состоянии sp 2 -гибридизации и образует три σ-связи и одну π-связь.
Одна из σ–связей – связь С–О, все три σ–связи расположены в одной плоскости под углом 120 о друг к другу.

π-Связь образована р-электронами атомов углерода и кислорода.
Из-за большей электроотрицательности атома кислорода по сравнению с атомом углерода связь С=О сильно поляризована, электронная плотность смещена к более электроотрицательному атому кислорода.
| На атоме кислорода возникает частичный отрицательный (δ – ), а на атоме углерода – частичный положительный (δ + ) заряды. |
Номенклатура карбонильных соединений
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-АЛЬ».
Нумерация ведется от атома углерода карбонильной группы.
| Например, 2-метилпропаналь |
- К названию кетонов добавляют в название суффикс «-ОН». После этого добавляют номер атомов углерода карбонильной группы.
| Например, пентанон-2 |
- Тривиальные названия альдегидов и кетонов приведены в таблице.
Изомерия карбонильных соединений
Изомерия альдегидов
Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода.
| Например. Ф ормуле С4Н8О соответствуют два альдегида-изомера углеродного скелета |
| Бутаналь | 2-Метилпропаналь |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Альдегиды являются межклассовыми изомерами с кетонами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для альдегидов, которые содержат не менее трех атомов углерода.
| Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3 |
| Пропаналь | Ацетон (пропанон) |
 |  |
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
| Например. Ф ормуле С5Н10О соответствуют кетоны-изомеры углеродного скелета |
| Пентанон-2 | 3-Метилбутанон-2 |
 |  |
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
| Например. Ф ормуле С5Н10О соответствуют два кетона-изомера углеродного скелета |
| Пентанон-2 | Пентанон-3 |
 |  |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
| Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3 |
| Пропаналь | Ацетон (пропанон) |
 |  |
Физические свойства альдегидов и кетонов
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
| Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. |
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении альдегиды превращаются в карбоновые кислоты. Альдегид → карбоновая кислота
|