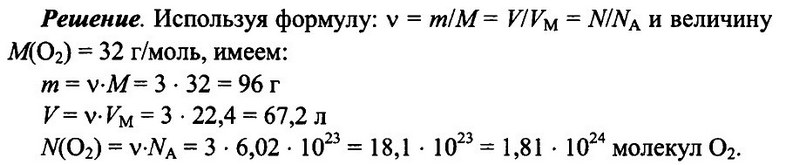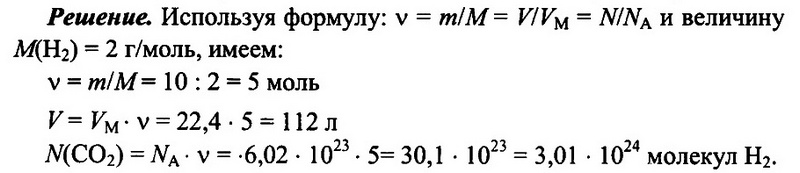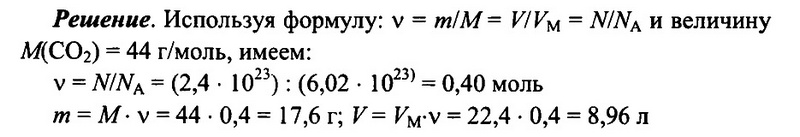Методы решения задач по химии. Задачи на вывод химической формулы вещества
Разделы: Химия
С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ (части В и С). Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
Вывод химической формулы вещества:
Номер задачи
(пример решения)
Вычисление молярной массы вещества
Задачи для самостоятельного решения
— на основании массовых долей (%) атомов элементов
M
Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3
— на основании массовых долей (%) атомов элементов и плотности соединения
М (CхНу) = D(Н2) ·М (Н2)
Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О
— по плотности вещества в газообразном состоянии
М (в-ва) = ρ · М (газообр. в-ва)
Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О
— на основании массовых долей (%) атомов элементов и массе соединения
М находится по соотношению,
или
M
Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода.
Ответ: C3Н8
— по массе или объёму исходного вещества и продуктам горения
М (в-ва)=Vm·ρ
Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.Ответ: C6H14О
Приводится пример решения задачи № 6 на применение уравнения Менделеева – Клайперона
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
Решение:
Рассчитать молярную массу кислоты CnН2n (N Н2) CОOH
w (О) =
M кислоты 
Найти число атомов углерода в молекуле кислоты и установить её формулу М = 12 n + 2 n + 16 + 45 =75
14 n = 14, n = 1
Ответ: формула кислоты NН2CН2CОOH
М (NН2CН2 CОOH) = 75 г/моль
Вывести формулу соединения
CnН2n (N Н2) CОOH
Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
Дано:
w (С) = 85,7 %
w (Н) = 14,3 %
D Н2 (CхНу) = 21
- Находим относительную молярную массу углеводорода, исходя из величины его относительной плотности: М (CхНу)=D (Н2) ·М (Н2)

m (Н) = 42г. /100% · 14,3 %= 6 г.
Находим количество вещества атомов углерода и водорода
n (С) = 36г :12 г/моль = 3 моль
n (Н) = 6г.: 1 г/моль = 6 моль
Ответ: истинная формула вещества C3Н6.
Вывести формулу соединения
CхНу- ?
Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
Дано:
Пары алкана в 2,5 раза тяжелее аргона
Решение:
По относительной плотности можно найти молярную массу алкана: М (C n Н 2 n + 2) = 14 n + 2 = 2,5 · М(Ar) = 100 г/моль
Откуда n = 7.
Ответ: формула алкана C7Н14
Вывести формулу алкана
C n Н2 n + 2
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
Дано:
w (С) = 39,97 %
w (Н) = 6,73 %
w (0) = 53,30 %
Vн.у. (CхHуОz) = 300 мл.
m (CхHуОz) = 2,41 г.
Решение:
Для расчёта выбираем 100г. соединения. Тогда масса углерода равна 39,97 г; водорода 6,73 г; кислорода 53,30 г.
1. Определяем количество вещества:
n (С) = 39,97г :12 г/моль = 3,33 моль
n (Н) = 6,73г.: 1,008 г/моль = 6,66 моль
n (0) = 53,3г.: 16 г/моль = 3,33 моль
Определяем наименьшее общее кратное – 3,33.
n (С) : n (Н) : n (0) = 1 : 2 : 1
Простейшая формула соединения – CH2О
М (CH2О) = 30 г/моль
Определяем молярную массу соединения по соотношению:
0,3 л. – 2,41 г.
22,4 л. – х г.
х = (22,4 · 2,41)/0,3 = 180
Или по формуле М= Vm · m/ V
К = 180 : 30 = 6
Определяем молекулярную формулу соединения, умножая стехиометрические коэффициенты в простейшей формуле на 6.
Ответ: искомая формула — C6H12О6
Вывести формулу соединения
CхНуОz- ?
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
Дано:
M (CхHу) = 4,4 г.
ρ (н.у.) = 1,97 г/л
V (СО2) = 6,72 л.
m (Н2О) = 7,2 г.
Решение:
1. Находим относительную молярную массу углеводорода, исходя из величины его относительной плотности:
М (CхHу) = Vm · ρ
М (CхHу) = 22,4л/моль · 1,97г/л = 44г/моль
2. Записываем в алгебраическом виде уравнение реакции горения газа, выразив коэффициенты через х и у.
Составляем пропорции:
4,4 / 44 = 6, 72/ х · 22,4
х = 44 · 6, 72/ 4,4 · 22,4 = 3
у = 44 · 7,2/ 4,4 · 9 = 8
Формула соединения C3H8; М (C3H8) = 44 г/моль
Ответ: молекулярная формула соединения C3H8
Вывести формулу
CхHу — ?
Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
Дано:
w (S) = 62,8 %
w (F) = 37,2 %
m (CхHу) = 0,51 г
V (CхHу) = 118 мл.
Т = 70
Р = 98,64 кПа
- Определяем простейшую формулу соединения:
n(S) : n(F) = 62,80/32 : 37,2/19 = 1,96 : 1,96 = 1 : 1
Простейшая формула S F
- Находим молярную массу соединения:
M
Следовательно, формула соединения S2 F2
Источник
2 способа задания вещества
Решение задач на количество вещества,
массу и объем
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, какое количества вещества содержится, какое число молекул содержится, определите объем (н.у.), определите массу, какова масса порции, определите молярную массу, назовите вещество, найдите молярную массу, определите абсолютную массу молекулы, сколько атомов содержится, определите относительную плотность.
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:

Vm = 22,4 л/моль (мл/ммоль, м 3 /кмоль) при н.у.,
Na = 6,02 • 10 23 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:
Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Задача № 1. Какое количество вещества содержится в 33 г оксида углерода (IV)?

Ответ: ν(СО2) = 0,75 моль.
Задача № 2. Какое число молекул содержится в 2,5 моль кислорода?

Ответ: N(O2) = 1,505 • 10 24 .
Задача № 3. Определите объем (н. у.), который займут 0,25 моль водорода.
Задача № 4. Какую массу будет иметь порция оксида серы (IV), объем которой 13,44 л (н. у.)?
Задача № 5. Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
Ответ: m = 96 г; V = 67.2 л; N(O2) = 1,81 • 10 24 .
Задача № 6. Имеется 10 г водорода Н2. Определите количество водорода, его объем при н.у., а также число имеющихся молекул водорода.
Ответ: 5 моль; 112 л; 3,01 • 10 24 .
Задача № 7. Имеется 56 л хлора Сl2 при н.у. Определите количество вещества хлора, его массу и число имеющихся молекул хлора.
Ответ: 2,5 моль; 177,5 г; 1,5 • 10 24 .
Задача № 8. Имеется 2,4 • 10 23 молекул оксида углерода (IV) СO2. Определите количество вещества углекислого газа, его массу, а также объем (н.у.) углекислого газа.
Ответ: 0,4 моль; 17,6 г; 8,96 л.
Задача № 9. Какова масса порции оксида азота (IV), содержащей 4,816 • 10 23 молекул? Каков ее объем (н. у.)?
Задача № 10. Масса порции простого вещества, содержащей 1,806 • 10 24 молекул, равна 6 г. Определите молярную массу данного вещества и назовите его.
Внимание! В данном конспекте рассматриваются задачи обычной сложности. Чтобы перейти к конспекту решения сложных задач на количественные характеристики и задачи с кратким ответом нажмите на кнопку ниже…
Решение задач на количество вещества, массу и объем. Выберите дальнейшие действия:
Источник
Методическая разработка по химии на тему «Решение химических задач»
Решение химических задач
Гринева Надежда Васильевна
учитель химии МОУ “ СОШ № 45 ”
«Умение решать задачи есть искусство,
Решение задач занимает в химическом образовании важное место, так как это один из приемов обучения, посредством которого обеспечивается более глубокое и полное усвоение учебного материала по химии и вырабатывается умение самостоятельного применения приобретённых знаний.
Умение решать задачи развивается в процессе обучения, и развить это умение можно только одним путём — постоянно, систематически решать задачи.
1. Система химических задач, их место в курсе методики обучения химии, классификация задач.
2. Формирование понятий о двух сторонах химической задачи.
3. Методические принципы обучения решению задач.
4. Методика использования задач на уроках химии.
5. Использование межпредметной информации при решении задач.
6. Задачи с экологическим содержанием.
7. Использование основных способов решения химических задач.
8. Список использованной литературы.
1. Система химических задач, их место в курсе методики обучения химии, классификация задач.
Решение химических задач — важнейшая сторона овладения знаниями основ наук химии. Включение задач в учебный процесс позволяет реализовывать следующие дидактические принципы обучения:
Обеспечение самостоятельности и активности учащихся;
Достижение прочности знаний и умений;
Осуществление связи обучения с жизнью
Реализация политехнического обучения химии, профессиональной ориентации.
Формирование умений решить задачи является одним из компонентов обучения химии. Для успешного преподавания химии необходимо использование основного дидактического принципа единства обучения, воспитания и развития.
Решение задач является одним из звеньев в прочном усвоении учебного материала ещё и потому, что формирование теорий и законов, запоминание правил, формул, составление химических уравнений происходит в действии.
У учащихся в процессе решения задач воспитываются трудолюбие, целеустремлённость, развивается чувство ответственности, упорство и настойчивость в достижении поставленной цели. В процессе решения задач реализуют межпредметные связи, показывающие единство природы , что позволяет развивать мировоззрение учащихся.
Окончательно разработанной классификации школьных химических задач не существует. Общепризнанной является классификация на две группы: расчетные (количественные) задачи и качественные. Каждая группа подразделяется на типы. Химические расчетные задачи условно делятся на три группы:
Задачи, решаемые с использованием химической формулы вещества или на вывод формулы
Задачи, для решения которых используют уравнения химических реакций
Задачи, связанные с растворами веществ.
2. Формирование понятий о двух сторонах химической задачи.
Использование химических задач в процессе обучения химии выполняет свою роль, если при их решении внимание обращается не только на вычисления, но и на химическую сущность задачи. Вещества и их превращения рассматриваются как с качественной, так и количественной стороны . Поэтому и в решении задач следует выделить две части: химическую и математическую.
Пути решения задач различны. Решение химической задачи состоит из многих операций, которые должны быть определённым образом связаны между собой, применяться в определенной последовательности, иметь определенную логику. Важным фактором обучения решению задач является необходимость отработки некоторой последовательности действий.
Внимательно прочитать текст задачи, постараться понять её сущность
Выполнить химическую часть решения задачи: записать условие задачи, используя общепринятые обозначения величин; произвести запись вспомогательных данных; произвести анализ задачи и наметить план её решения.
Выбрать наиболее рациональный способ решения
Произвести необходимые расчеты
Записать ответ задачи
Провести проверку полученного результата.
9 класс. Тема урока: «Серная кислота»
Задачи: Найти массовую долю серной кислоты в растворе , если при полном растворении меди в 50 г горячего раствора этой кислоты, выделился газ, взаимодействии которого с избытком сероводорода даёт 19,2 г серы?
n=1 моль n= 3моль
3.Из 2 го ур-ния : а) n ( S ) = m / M = 19,2 г/32 г/моль = 0,6 моль
б) n ( SO 2) = 0,6 моль/3 = 0,2 моль =>
4. Из 1 го ур-ния : а) 0,2 моль образовалось SO 2
б) вступило в реакцию 0,4 моль H 2 SO 4
5. m ( H 2 SO 4) вст. = M * n = 98 г/моль * 0,4 моль = 39,2 г
6. w(H 2 SO 4 ) = (m(H 2 SO 4 )/m( р — ра H 2 SO 4 )) * 100% = (39,2 г /50 г ) * 100% = 78,4 %
3. Методические принципы обучения решению задач.
Первоначально учитель решает задачу сам и придумывает методику разбора задачи.
Учащиеся должны постоянно видеть текст задачи
Учащиеся должны проявлять самостоятельность , решая задачи.
Учащиеся следует проводить самоанализ , контролируя решение задачи.
Учитель должен систематически включать решение задачи в процесс обучения химии.
11 класс. Тема урока: «Электролиз»
Задача: 20 г сплава меди и алюминия растворили в концентрированной азотной кислоте. При электролизе образовавшегося раствора на аноде выделилось 2,8 л газа. Определите процентный состав металлов в сплаве. Рассчитайте объем газа , выделившегося при растворении сплава в азотной кислоте.
С конц. HNO 3 Al не взаимодействует.
Определяем кол-во O 2 , Cu ( NO 3)2 , Cu
n ( O 2) = V / V m = 2,8 л/22,4 л/моль = 0,125 моль => из 3 го уравнения n ( Cu ( NO 3)2)=2 n ( O 2)=0,125 моль * 2 = 0,25 моль
Из 2 го ур-ния n ( Cu )= n ( Cu ( NO 3)2)=0,25 моль
Определяем m ( Cu ) и m ( Al )
а) m ( Cu ) = M * n = 64 г/моль * 0,25 моль = 16 г
б) m ( Al ) = m (сплава) – m ( Cu ) = 20г – 16г = 4г
8. w(Cu) = (16 г/20г) * 100% = 80%
w ( Al ) = (4г/20г) * 100% = 20%
9.Из 1 го уравнения : а) n ( NO 2) = 2 n ( Cu ) = 0,25 * 2 = 0,5 моль ,
б) V ( NO 2) = V m * n = 22,4 г/моль * 0,5 моль = 11,2 л
Ответ : V(NO 2 ) = 11,2 л , w(Cu) = 80% , w(Al) = 20%.
Задача решена, но это не самое главное , главным является повторение определенных химических понятий, связанных с задачей, или рассмотрение нового фактического материала , овладение новыми приёмами мышления , т.е. каждая задача должна давать новые знания и умения. Поэтому , получив правильный результат решения задачи, нельзя считать, что всё закончено. Следует проверить, как ученик получил решение? Какие знания ему было нужно применить для получения ответа? Сможет ли он доказать правильность решения, т.е. сможет ли сделать проверку своего решения? Успех выработки умений решать задачи зависит от постоянного решения в течение всего учебного года, так и от последовательности решения одной задачи за другой, т.е. системы задач, с помощью которых можно было бы руководить умственным развитием учащихся при изучении нового материала.
4. Методика использования задач на уроках химии.
Разнообразить методы преподавания химии можно, применяя задачи на различных этапах урока : при изучении нового материала ; в процессе закрепления материала , изученного на уроке; при самостоятельной работе на уроке и дома; при текущей проверке знаний учащихся; при повторении изученной темы и поведение проверочной или контрольной работы; при обобщении знаний учащихся по теме.
Например : при изучении темы 8-ой класс «Растворы и их приготовление»
Задача. Как приготовить 50 г 10 % раствора H 2 SO 4, исходя из 96% серной кислоты (р-1,84 г/мл)
m (безводн. H 2 SO 4) = m ( р-ра ) * w = 50г. * 0,1 = 5г
w ( р.в. ) = (m ( в ) / (p* V)) * 100%
а) 96 = (5/(1,84* V)) * 100 = > 0,96 = (5/(1,84* V)) => 0,96*1,84*V = 5 => V = 5 /(0,96*1,84) = 5/1,7664 = 2,83 мл
б) m ( 96% H 2 SO 4 ) = p * V = 1,84г * 2,83 мл = 5,2г
3. m(H 2 O) = 50 г – 5,2г = 44,8г
Ответ: 2,83 мл 96-%-ной H 2 SO 4 тонкой струйкой медленно добавляют в H 2 O массой 44,8 г.
5. Использование межпредметной информации при решении задач.
Использование межпредметной информации в процессе решения задач способствует более глубокому и осмысленному усвоению программного материала, учащиеся приобретают и совершенствуют , практические умения выявлять причинно-следственные связи между явлениями , процессами. При этом создаются благоприятные условия для осмысленного понимая фактов, теорий , законов , конкретизация и углубления ранее приобретенных знаний по химии, физике, биологии. Расчетные задачи с межпредметным содержанием могут быть использованы на всех стадиях обучения химии. При изучении химии используют следующие виды расчётных задач с межпредметным содержанием:
Определение состава минеральных удобрений
Расчеты растворов, которые играют важную роль в промышленности, медицине, сельском хозяйстве, природе
Термохимические и энергетические расчёты
Расчеты на основе использования газовых законов
Расчеты по электрохимии
Распознание веществ и их состава на основе качественных реакций
Для решения задач требуется химическая, биологическая и физическая информация.
8 класс. Тема урока: «Растворы»
Задача: При некоторых заболеваниях в кровь вводят 0,85% раствор поваренной соли, называемым физиологическим раствором. Вычислите: а) сколько воды и соли нужно взять для получения 5 кг физиологического раствора; б) сколько соли вводится в организм при вливании 400 г физиологического раствора
а) 100 г — 0,85 г соли
5000 г — х г соли
х г соли = (0,85*5000 г)/100г = 42,5 г
б) m ( H 2 O ) = 5000г – 42,5г = 4957,5г, т.е. для получения 5кг физиологического раствора необходимо 42,5г соли растворить в 4957,5г H 2 O .
2) Сколько соли вводится в организм при вливании раствора?
100 г р-ра — 0,85 г соли
400 г р-ра — х г соли
х г соли = (0,85*400г)/100 = 3,4г
6. Задачи с экологическим содержанием.
Экологизация школьного курса химии обусловлена необходимостью готовить школьников к активному участию в решении насущных проблем защиты окружающей среды от загрязнения. В настоящее время вопросы экологии находят свое отражение в новых научных программах и содержания курса химии. Одним из эффективных методов формирования экологических знаний и умений школьников становится решение задач по экологической проблематике. Их оптимальное использование в учебном процессе позволяет сделать теоретический материал аргументированным, жизненным и менее академичным. В поисках ответа на вопрос задачи ученик невольно становится сопричастным к проблемам защиты природы. В условиях задач могут быть включены следующие проблемы:
Двойственная роль химии – она, с одной стороны, служит человеку и природе, а с другой – приводит к нарушению биогеохимических процессов при неразумном использовании ее достижений человеком; влияние отдельных химических элементов и их соединений на живые организмы; технологическое несовершенство производства, связанное с много стадийностью химических процессов накоплением отходов, появлением побочных продуктов, попаданием вредных веществ в природную среду. Физиологическое воздействие отходов химической промышленности на человека и животных в рамках системы «человек – производство — природа».
Исходные данные для составления задач с экологическим содержанием можно получить из справочной и научно – популярной литературы, учебных пособий, статей и периодических изданий. Среди разнообразных задач можно выделить 3 группы задач с экологическим содержанием.
Задачи, которые позволяют раскрыть структуру и функционирование природных систем, выявить экологические проблемы, связанные с нарушениями равновесия в биосферных процессах, истощением природных ресурсов и ухудшением качества окружающей среды в результате ее загрязнения отходами химических и других производств.
10 класс. Тема урока «Нефть»
Задача: На нефтеперерабатывающем заводе негерметичное соединение коммуникаций иногда приводит к утечке бензина или другого нефтепродукта. Например, при утечке одной капли бензина в секунду потери топлива в месяц составляют 130 л, а в год 1560 л. Сколько км мог бы пройти автомобиль в месяц и в год на потерянном топливе, если его расход составляет 15 л на 100 км?
130 л : 15 л = 8,7 раз
100 км х 8,7 = 870 км мог бы пройти автомобиль в месяц на потерянном топливе.
2) 1560 л : 15 л = 104 раза мог бы пройти автомобиль в год на потерянном топливе.
7. Использование основных способов решения химических задач.
Постоянно обращаю внимание учащихся на то , что почти каждая химическая задача может быть решена несколькими способами. Всегда готова принять различные варианты решения конкретной задачи. Знание разнообразных подходов к решению задач создаёт у учащегося необходимую базу для выбора нужного способа решения задач нового типа. Разные способы решения задач способствуют развитию мышления учащихся.
При решении задач можно использовать разные способы:
соотношение масс веществ ;
сравнение масс веществ ;
использование величины «количество вещества» и её единицы «моль»;
Задача. В лаборатории была доставлена руда , содержащая 306 г Al 2 O 3. Какая масса алюминия содержится в руде?
1 способ (соотношение масс веществ).
Дано: 1. 1 моль ( Al 2 O 3) – 2 моль ( Al )
————————- Ar ( Al ) = 27 , M ( Al ) = 27 * 2 = 54 г/моль
m ( Al ) — ? 3. m ( Al ) : m ( Al 2 O 3) = 54 : 102 = 1 : 1,888 , т.е. Al в алюминиевой руде будет содержаться в 1,888 раза меньше, т.е. m ( Al ) = 306 : : 1,888 = 162 г
2 способ (сравнение масс веществ).
Дано: 1. 1 моль ( Al 2 O 3) – 2 моль ( Al )
m(Al 2 O 3 ) = 306 г 2. Mr(Al 2 O 3 ) = 102 , Ar(Al) = 27
m ( Al ) — ? m ( A l ) = Mr = 27г/моль * 2 моль = 54г
3. 306г ( Al 2 O 3)/ 102г ( Al 2 O 3) = 3 раза => в 3 раза больше будет находиться алюминия в руде, т.е. m ( Al ) = 54г * 3 = 162г
3 способ (использование величины «количества вещества» и её единицы «моль»).
Дано : 1. 1 моль (Al 2 O 3 ) – 2 моль (Al)
m(Al 2 O 3 ) = 306 г 2. n(Al 2 O 3 ) = m/M = 306 г /102 г / моль = 3 моль
m ( Al ) — ? 3 моль ( Al 2 O 3) – х моль ( Al )
4. x моль ( Al ) = 3 * 2 = 6 моль
5. m ( Al ) = M * n = 27 г/моль * 6 моль = 162 г
Преимущество этого способа решения заключается в том, что учащиеся глубже и отчетливее осознают качественную и количественную сторону химической формулы.
4 способ (составление пропорции).
Дано: 1. 1 моль ( Al 2 O 3) – 2 моль ( Al )
m(Al 2 O 3 ) = 306 г 2. Mr(Al 2 O 3 ) = 102 , Ar(Al) = 27
m ( Al ) — ? m ( Al ) = Mr = 27г/моль * 2 моль = 54г
102г/306г = 54г/ x = > x г (Al) = (306*54) /102 = 162 г
5 способ (использование коэффициента пропорциональности).
При расчетах по химическим формулам веществ коэффициент пропорциональности равен k = m / Mr . Тогда масса элемента в веществе будет равна произведению коэффициента пропорциональности на Ar элемента и число атомов элемента. m (эл) = k * n * Ar , где n – число атомов элемента.
Дано: 1. k = m / Mr , k = 306/102 = 3
m(Al 2 O 3 ) = 306 г 2. m(Al) = k * 2 * Ar(Al) = 3*2*27 = 162 г
Рассмотренные выше способы решения химических задач не единственные. Однако указанного числа способов решения достаточно, чтобы показать учащимся различные пути решения химических задач, не ограничивать их мышление только одним способом умственной деятельности, быть справедливым по отношению к тем учащимся, которые решают задачу правильно, но не так, как объяснял учитель.
8. Список использованной литературы.
1. Адамович Т.П. ,Васильева Г.И. , Мечковский С.А. «Сборник олимпиадных задач по химии» — Минск: Народная асвета,1980 г.
2. Гаврусейко Н.П. «Сборник самостоятельных и контрольных работ по химии» Минск: Народная асвета,1983 г.
3. Кайгородова Г.А.Обучение учащихся решению расчетных задач по химии» Смоленск,1984 г.
4. Гузей Л.С. , Лунин В.В. «Сборник задач по общей химии с производственным содержанием» — М.:Высшая школа,1977 г.
5. Ерыгин Д.П. , Орлова Л.Н. «Задачи и примеры с межпредметным содержанием» Пособие для студентов и учителей. – М.МГПИ им В.И Ленина, 1981 г.
6. Иванова Р.Г. , Черкасов А.М. «Изучение химии в 7-8 классах» -М.Просвещение,1980 г.
7. Колягин Ю.М. , Оганесян В.А. «Учись решать задачи».- М.: Просвещение,1980 г.
8. Лунькова Н.О. «Анализировать ход поиска решений». Техника и наука-1984 г. №11 с.34.
9. Потапов В.М. Чертков И.Н. «Проверь свои знания по органической химии»-М.: Просвещение,1979 г.
10. Хомченко Г.П. , Хомченко И.Г.»Задачи по химии для поступающих в ВУЗы».-М.: Высшая школа,1996 г.
11. Хрусталева А.Ф. «Выбирать оптимальные варианты решения задач».Химия в школе.1984 г. №1.
12. Середа И.П. «Конкурсные задачи по химии». Киев:Вица школа.1984г.
13. Александрова Е.А.,Губанова Е.В. «Методика сочетания продуктивного и задачного подходов в обучению школьников». Москва-2005.
Источник